Physique-Chimie > Physique Quantique (Notions Terminale) > Dualité Onde-Corpuscule > Photon et énergie quantifiée
Photon et énergie quantifiée
Découvrez la nature du photon, son énergie quantifiée et son rôle dans la dualité onde-corpuscule. Comprenez comment l'énergie lumineuse est émise et absorbée par paquets discrets.
Introduction au Photon
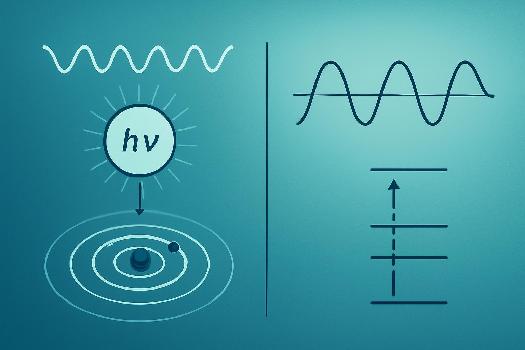
Le photon est la particule élémentaire associée à la lumière et, plus généralement, à toutes les formes de rayonnement électromagnétique. Il est le quantum d'énergie de ce rayonnement. Contrairement à une idée classique de la lumière comme une onde continue, la physique quantique révèle que la lumière se comporte parfois comme une particule discrète : le photon. C'est ce que l'on appelle la dualité onde-corpuscule.
La Quantification de l'Énergie du Photon
L'énergie d'un photon n'est pas continue, mais quantifiée, c'est-à-dire qu'elle ne peut prendre que certaines valeurs discrètes. Cette énergie est directement proportionnelle à la fréquence du rayonnement électromagnétique et inversement proportionnelle à sa longueur d'onde. La relation fondamentale qui relie l'énergie E d'un photon à sa fréquence ν (nu) est donnée par la formule d'Einstein-Planck: E = hν où:
- E est l'énergie du photon (en Joules, J)
- h est la constante de Planck (environ 6.626 x 10-34 J.s)
- ν est la fréquence du rayonnement (en Hertz, Hz)
Exemples concrets
- Lumière visible: La lumière rouge a une longueur d'onde plus longue que la lumière bleue. Par conséquent, les photons de lumière rouge ont une énergie plus faible que les photons de lumière bleue.
- Rayonnement UV: Le rayonnement ultraviolet a une fréquence plus élevée que la lumière visible. C'est pourquoi l'exposition aux UV peut être dangereuse, car les photons UV ont une énergie suffisamment élevée pour endommager les molécules de la peau.
- Laser: Les lasers émettent une lumière monochromatique (une seule longueur d'onde) composée de photons ayant tous la même énergie.
Le Photon et la Dualité Onde-Corpuscule
Le concept de photon est essentiel pour comprendre la dualité onde-corpuscule de la lumière. Dans certaines situations, la lumière se comporte comme une onde (par exemple, lors de la diffraction ou de l'interférence). Dans d'autres situations, elle se comporte comme un flux de particules (photons, par exemple, lors de l'effet photoélectrique). Cette dualité n'est pas une contradiction, mais une caractéristique fondamentale de la nature de la lumière et, plus généralement, de toutes les particules élémentaires. L'expéreince des fentes de Young est un exemple flagrant.
Absorption et Émission de Photons
Les atomes et les molécules peuvent absorber ou émettre des photons. Lorsqu'un atome absorbe un photon, il passe à un niveau d'énergie supérieur. L'énergie du photon absorbé doit correspondre exactement à la différence d'énergie entre les deux niveaux d'énergie de l'atome. De même, lorsqu'un atome passe à un niveau d'énergie inférieur, il émet un photon dont l'énergie est égale à la différence d'énergie entre les deux niveaux. C'est le principe de la spectroscopie.
Applications
- Panneaux solaires: Les panneaux solaires utilisent l'effet photoélectrique pour convertir l'énergie des photons solaires en énergie électrique.
- Photographie numérique: Les capteurs des appareils photo numériques sont constitués de cellules photosensibles qui absorbent les photons et les convertissent en signaux électriques.
- Spectroscopie: La spectroscopie utilise l'absorption et l'émission de photons par les atomes et les molécules pour identifier et quantifier les substances chimiques.
Ce qu'il faut retenir
- Le photon est la particule élémentaire de la lumière, un quantum d'énergie.
- L'énergie d'un photon est quantifiée : E = hν = hc/λ
- La lumière présente une dualité onde-corpuscule.
- Les atomes absorbent et émettent des photons lors des transitions entre niveaux d'énergie.
- Le concept de photon a de nombreuses applications technologiques.
FAQ
-
Qu'est-ce que la constante de Planck ?
La constante de Planck (h) est une constante fondamentale de la physique quantique qui relie l'énergie d'un photon à sa fréquence. Sa valeur est environ 6.626 x 10-34 J.s. -
Comment l'énergie d'un photon est-elle liée à sa couleur ?
La couleur d'un photon (dans le spectre visible) est directement liée à sa longueur d'onde et donc à son énergie. Les photons de lumière bleue ont une longueur d'onde plus courte et une énergie plus élevée que les photons de lumière rouge. -
Est-ce que toutes les ondes électromagnétiques sont composées de photons ?
Oui, toutes les ondes électromagnétiques, des ondes radio aux rayons gamma, sont composées de photons. La seule différence est l'énergie des photons.
