Physique-Chimie > Chimie - La Matière et ses Transformations > Réactions Chimiques > Équations chimiques (écriture et équilibrage)
Identifier les réactions chimiques
Découvrez les différents types de réactions chimiques et les indices qui permettent de les identifier. Comprenez les transformations physiques et chimiques, et apprenez à différencier les réactions de synthèse, de décomposition, de substitution et de double substitution. Des exemples concrets illustreront chaque type de réaction.
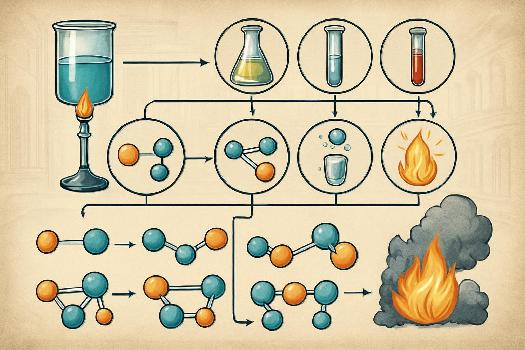
Transformation physique vs. Transformation chimique
Il est essentiel de distinguer une transformation physique d'une transformation chimique.
Transformation physique : Une transformation physique modifie l'apparence ou l'état d'une substance, mais ne change pas sa composition chimique. Par exemple, la fusion de la glace en eau ou l'ébullition de l'eau en vapeur sont des transformations physiques. La substance reste de l'eau (H2O) dans tous les cas.
Transformation chimique : Une transformation chimique (ou réaction chimique) implique la réorganisation des atomes et la formation de nouvelles substances. Les réactifs sont transformés en produits ayant des propriétés chimiques différentes. Par exemple, la combustion du bois est une transformation chimique où le bois réagit avec l'oxygène pour former du dioxyde de carbone, de l'eau et de la cendre.
Indices d'une réaction chimique
Plusieurs indices peuvent suggérer qu'une réaction chimique a eu lieu :
- Changement de couleur : Un changement de couleur peut indiquer la formation d'une nouvelle substance.
- Formation d'un précipité : La formation d'un solide insoluble (précipité) dans une solution.
- Dégagement de gaz : La production de bulles de gaz.
- Changement de température : Une réaction peut être exothermique (dégage de la chaleur) ou endothermique (absorbe de la chaleur).
- Émission de lumière : Certaines réactions chimiques produisent de la lumière (chimiluminescence).
Types de réactions chimiques
Il existe plusieurs types de réactions chimiques courantes :
1. Réaction de synthèse (ou combinaison) : Deux ou plusieurs réactifs se combinent pour former un seul produit.
A + B → AB
Exemple : 2H2 + O2 → 2H2O
2. Réaction de décomposition : Un seul réactif se décompose en deux ou plusieurs produits.
AB → A + B
Exemple : 2H2O → 2H2 + O2
3. Réaction de substitution (ou remplacement simple) : Un élément remplace un autre élément dans un composé.
A + BC → AC + B
Exemple : Zn + 2HCl → ZnCl2 + H2
4. Réaction de double substitution (ou double remplacement) : Les ions de deux composés échangent leurs partenaires.
AB + CD → AD + CB
Exemple : AgNO3 + NaCl → AgCl + NaNO3
5. Réaction de combustion : Une substance réagit rapidement avec l'oxygène, généralement en produisant de la chaleur et de la lumière.
Hydrocarbure + O2 → CO2 + H2O
Exemple : CH4 + 2O2 → CO2 + 2H2O
6. Réaction acide-base (Neutralisation): Une réaction entre un acide et une base, généralement produisant un sel et de l'eau.
HA + BOH -> BA + H2O
Exemple : HCl + NaOH -> NaCl + H2O
7. Réaction d'oxydoréduction (Redox): Une réaction impliquant un transfert d'électrons entre les espèces chimiques.
Exemple: Zn + Cu2+ -> Zn2+ + Cu
Exemples concrets et identification
Voici quelques exemples pour illustrer comment identifier les types de réactions :
Exemple 1 : Rouille du fer (synthèse/oxydation)
4Fe(s) + 3O2(g) → 2Fe2O3(s)
Identification : Il s'agit d'une réaction de synthèse où le fer réagit avec l'oxygène pour former de l'oxyde de fer (rouille). On observe un changement de couleur et la formation d'un solide brun-rougeâtre.
Exemple 2 : Électrolyse de l'eau (décomposition)
2H2O(l) → 2H2(g) + O2(g)
Identification : Il s'agit d'une réaction de décomposition où l'eau est décomposée en hydrogène et oxygène par l'électricité. On observe la formation de bulles de gaz.
Exemple 3 : Réaction du zinc avec l'acide chlorhydrique (substitution)
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Identification : Il s'agit d'une réaction de substitution où le zinc remplace l'hydrogène dans l'acide chlorhydrique. On observe la formation de bulles de gaz (hydrogène).
Exemple 4 : Précipitation du chlorure d'argent (double substitution)
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
Identification : Il s'agit d'une réaction de double substitution où l'argent et le sodium échangent leurs partenaires. On observe la formation d'un précipité blanc de chlorure d'argent.
Ce qu'il faut retenir
- Une transformation physique modifie l'état ou l'apparence d'une substance sans changer sa composition chimique, tandis qu'une transformation chimique crée de nouvelles substances.
- Les indices d'une réaction chimique incluent les changements de couleur, la formation d'un précipité, le dégagement de gaz, les changements de température et l'émission de lumière.
- Les principaux types de réactions chimiques sont la synthèse, la décomposition, la substitution, la double substitution et la combustion.
- L'identification du type de réaction permet de mieux comprendre les processus chimiques impliqués.
FAQ
-
Une réaction chimique peut-elle appartenir à plusieurs catégories en même temps ?
Oui, certaines réactions peuvent être classées dans plusieurs catégories. Par exemple, la combustion est à la fois une réaction de combustion et une réaction d'oxydoréduction. -
Comment puis-je savoir si un changement de couleur est dû à une réaction chimique ou à un simple mélange ?
Un simple mélange de couleurs ne constitue pas une réaction chimique. Si la couleur change radicalement et de manière permanente après le mélange, et qu'elle s'accompagne d'autres indices tels que la formation d'un précipité ou le dégagement de gaz, il est plus probable qu'une réaction chimique ait eu lieu.
