Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Géométrie des molécules (VSEPR - notions)
Géométrie des Molécules : La Théorie VSEPR
Explorez la théorie VSEPR (Valence Shell Electron Pair Repulsion) pour prédire la géométrie des molécules. Comprenez comment les paires d'électrons autour d'un atome central se repoussent mutuellement et influencent la forme moléculaire. Apprenez à déterminer la géométrie électronique et moléculaire à partir de la formule de Lewis.
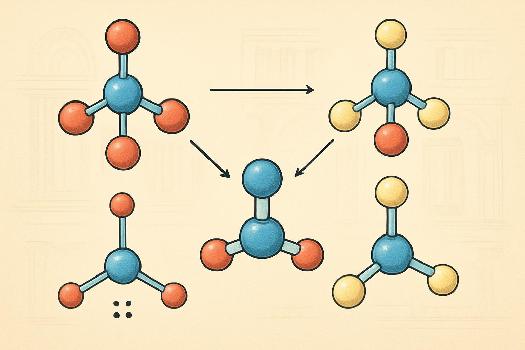
Introduction à la Théorie VSEPR
La théorie VSEPR (Valence Shell Electron Pair Repulsion), ou théorie de la répulsion des paires électroniques de la couche de valence, est un modèle utilisé en chimie pour prédire la géométrie des molécules. Elle repose sur l'idée que les paires d'électrons, qu'elles soient liantes (liées à d'autres atomes) ou non liantes (paires libres), se repoussent mutuellement. Cette répulsion amène les paires d'électrons à s'éloigner le plus possible les unes des autres, déterminant ainsi la forme de la molécule.
En d'autres termes, la théorie VSEPR considère que les atomes se disposent autour de l'atome central de façon à minimiser la répulsion entre les nuages électroniques (liaisons et paires non liantes).
Les Types de Paires d'Électrons
Il est crucial de distinguer deux types de paires d'électrons autour de l'atome central :
- Paires liantes : Ces paires d'électrons sont impliquées dans la formation de liaisons covalentes avec d'autres atomes.
- Paires non liantes (paires libres) : Ces paires d'électrons ne sont pas impliquées dans la formation de liaisons. Elles sont situées sur l'atome central et exercent une répulsion plus forte que les paires liantes.
Géométrie Électronique vs. Géométrie Moléculaire
Il est important de faire la distinction entre la géométrie électronique et la géométrie moléculaire :
- Géométrie électronique : Elle prend en compte toutes les paires d'électrons autour de l'atome central, qu'elles soient liantes ou non liantes. Elle décrit la disposition spatiale des nuages électroniques.
- Géométrie moléculaire : Elle ne tient compte que de la position des atomes liés à l'atome central. Elle décrit la forme de la molécule elle-même, c'est-à-dire comment les atomes sont agencés les uns par rapport aux autres.
Par exemple, la molécule d'eau (H2O) a une géométrie électronique tétraédrique (car il y a 4 nuages électroniques : 2 liaisons O-H et 2 paires non liantes sur l'oxygène), mais sa géométrie moléculaire est coudée (ou angulaire) car on ne considère que les atomes d'oxygène et d'hydrogène.
Déterminer la Géométrie Moléculaire : Guide Étape par Étape
Voici les étapes à suivre pour déterminer la géométrie moléculaire d'une molécule en utilisant la théorie VSEPR :
- Dessiner la structure de Lewis de la molécule : Identifiez l'atome central et dessinez la structure de Lewis en respectant la règle de l'octet (ou du duet pour l'hydrogène).
- Compter le nombre de paires d'électrons autour de l'atome central : Comptez à la fois les paires liantes et les paires non liantes.
- Déterminer la géométrie électronique : En fonction du nombre total de paires d'électrons, déterminez la géométrie électronique correspondante (linéaire, trigonal planaire, tétraédrique, etc.).
- Déterminer la géométrie moléculaire : En tenant compte du nombre de paires non liantes, déterminez la géométrie moléculaire en considérant uniquement la position des atomes. La présence de paires non liantes déforme la géométrie électronique idéale.
Tableau récapitulatif des géométries :
| Nombre total de paires d'électrons | Nombre de paires liantes | Nombre de paires non liantes | Géométrie électronique | Géométrie moléculaire | Exemples |
|---|---|---|---|---|---|
| 2 | 2 | 0 | Linéaire | Linéaire | BeCl2, CO2 |
| 3 | 3 | 0 | Trigonal planaire | Trigonal planaire | BF3 |
| 3 | 2 | 1 | Trigonal planaire | Coudée | SO2 |
| 4 | 4 | 0 | Tétraédrique | Tétraédrique | CH4 |
| 4 | 3 | 1 | Tétraédrique | Pyramidale | NH3 |
| 4 | 2 | 2 | Tétraédrique | Coudée | H2O |
Influence des Paires Non Liantes
Les paires non liantes exercent une répulsion plus forte que les paires liantes. Cela a pour conséquence de modifier les angles de liaison et de déformer la géométrie moléculaire. Par exemple, dans la molécule d'ammoniac (NH3), la présence d'une paire non liante sur l'azote réduit l'angle entre les liaisons N-H, rendant la molécule pyramidale au lieu de tétraédrique.
Exemples d'application
Appliquons la théorie VSEPR à quelques exemples concrets :
- Dioxyde de Carbone (CO2) : L'atome central est le carbone. Il y a deux liaisons doubles C=O et aucune paire non liante. La géométrie électronique et moléculaire sont linéaires.
- Méthane (CH4) : L'atome central est le carbone. Il y a quatre liaisons simples C-H et aucune paire non liante. La géométrie électronique et moléculaire sont tétraédriques.
- Ammoniac (NH3) : L'atome central est l'azote. Il y a trois liaisons simples N-H et une paire non liante. La géométrie électronique est tétraédrique, mais la géométrie moléculaire est pyramidale.
- Eau (H2O) : L'atome central est l'oxygène. Il y a deux liaisons simples O-H et deux paires non liantes. La géométrie électronique est tétraédrique, mais la géométrie moléculaire est coudée.
Ce qu'il faut retenir
- La théorie VSEPR prédit la géométrie des molécules en minimisant la répulsion entre les paires d'électrons.
- Il faut distinguer les paires liantes et non liantes.
- La géométrie électronique prend en compte toutes les paires d'électrons, tandis que la géométrie moléculaire ne considère que la position des atomes.
- Les paires non liantes exercent une répulsion plus forte, déformant la géométrie.
- La structure de Lewis est la base pour appliquer la théorie VSEPR.
FAQ
-
Qu'est-ce que la théorie VSEPR et quel est son but ?
La théorie VSEPR (Valence Shell Electron Pair Repulsion) est un modèle utilisé pour prédire la géométrie des molécules en se basant sur la répulsion entre les paires d'électrons autour de l'atome central. -
Quelle est la différence entre géométrie électronique et géométrie moléculaire ?
La géométrie électronique prend en compte toutes les paires d'électrons (liantes et non liantes), tandis que la géométrie moléculaire ne considère que la position des atomes, déterminant ainsi la forme visible de la molécule. -
Comment la présence de paires non liantes affecte-t-elle la géométrie moléculaire ?
Les paires non liantes exercent une répulsion plus forte que les paires liantes, ce qui a pour effet de déformer la géométrie moléculaire et de réduire les angles de liaison.
