Physique-Chimie > Chimie - Thermochimie (Notions) > Énergie et Réactions Chimiques > Loi de Hess (notions)
La Loi de Hess : Calcul des Variations d'Enthalpie
Comprendre et appliquer la loi de Hess pour déterminer les variations d'enthalpie de réactions chimiques, un outil essentiel en thermochimie.
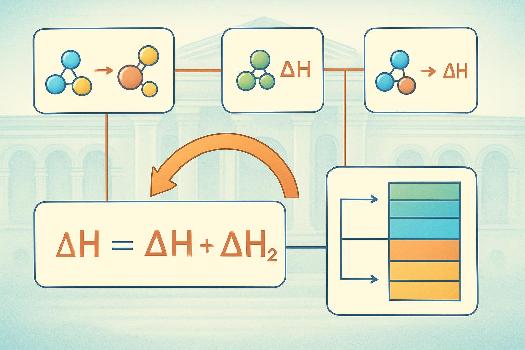
Introduction à la Loi de Hess
La loi de Hess est un principe fondamental de la thermochimie qui stipule que la variation d'enthalpie d'une réaction chimique ne dépend que de l'état initial et de l'état final, et non du chemin suivi pour atteindre cet état. Autrement dit, si une réaction peut être réalisée en une seule étape ou en plusieurs étapes, la variation d'enthalpie totale sera la même dans les deux cas. Cela simplifie considérablement le calcul des enthalpies de réaction, en particulier pour les réactions qui ne peuvent pas être mesurées directement.
Énoncé de la Loi de Hess
Énoncé précis : La variation d'enthalpie (ΔH) d'une réaction chimique est indépendante du chemin réactionnel suivi, elle ne dépend que de l'état initial (réactifs) et de l'état final (produits).
Conséquences importantes :
- Il est possible de calculer ΔH d'une réaction en additionnant les ΔH des étapes intermédiaires.
- Si une réaction est inversée, le signe de ΔH change.
- Si les coefficients stœchiométriques d'une réaction sont multipliés par un facteur, ΔH est également multiplié par ce facteur.
Représentation Graphique : Cycles Thermochimiques
Pour visualiser et appliquer la loi de Hess, on utilise souvent des cycles thermochimiques.
Principe : Un cycle thermochimique est une représentation graphique des différentes étapes d'une réaction, formant un cycle fermé. La somme des variations d'enthalpie le long du cycle est égale à zéro. Cela permet de déterminer une variation d'enthalpie inconnue en connaissant les autres.
Exemple : Imaginons une réaction A → C qui peut se faire directement ou en passant par une étape intermédiaire B.
Voici une représentation sous forme de tableau :
| Chemin Direct | Chemin Indirect |
|---|---|
| A → C (ΔH1) | A → B (ΔH2) puis B → C (ΔH3) |
Applications Pratiques de la Loi de Hess
La loi de Hess est utilisée pour :
- Calculer les enthalpies de réaction qui ne peuvent pas être mesurées directement (réactions trop lentes, trop rapides, ou impliquant des composés instables).
- Déterminer les enthalpies de formation standard de composés.
- Prévoir le dégagement ou l'absorption de chaleur dans une réaction.
Exemple concret : Calcul de l'enthalpie de formation du méthane (CH4) à partir des enthalpies de combustion du carbone, de l'hydrogène et du méthane. Même si on ne peut pas former du méthane directement à partir de ses éléments en conditions standard, on peut utiliser les enthalpies de combustion pour calculer son enthalpie de formation grâce à la loi de Hess.
Méthodologie de Résolution de Problèmes
Voici une méthode étape par étape pour résoudre les problèmes impliquant la loi de Hess :
- Identifier la réaction cible dont l'enthalpie est inconnue.
- Identifier les réactions intermédiaires dont les enthalpies sont connues.
- Manipuler les réactions intermédiaires (inversion, multiplication) pour qu'elles, une fois additionnées, donnent la réaction cible. Attention : n'oubliez pas de modifier les enthalpies correspondantes!
- Additionner les enthalpies des réactions intermédiaires manipulées pour obtenir l'enthalpie de la réaction cible.
Conseils : Visualisez les réactions avec des cycles thermochimiques. Soyez attentif aux états physiques des composés (solide, liquide, gaz) car ils affectent l'enthalpie.
Enthalpies de formation standard
L'enthalpie de formation standard d'un composé est la variation d'enthalpie lorsqu'une mole de ce composé est formée à partir de ses éléments constitutifs dans leur état standard (298 K et 1 atm).
La loi de Hess permet de calculer les enthalpies de réaction à partir des enthalpies de formation standard des réactifs et des produits :
ΔHréaction = Σ ΔHf°(produits) - Σ ΔHf°(réactifs)
Où ΔHf° représente l'enthalpie de formation standard de chaque espèce chimique.
Note Importante : L'enthalpie de formation standard d'un élément dans son état standard est, par définition, égale à zéro.
Ce qu'il faut retenir
- La loi de Hess stipule que la variation d'enthalpie d'une réaction ne dépend que de l'état initial et final.
- Les cycles thermochimiques permettent de visualiser et d'appliquer la loi de Hess.
- La loi de Hess est utilisée pour calculer les enthalpies de réactions impossibles à mesurer directement.
- Les enthalpies de formation standard sont essentielles pour les calculs d'enthalpie basés sur la loi de Hess.
- ΔHréaction = Σ ΔHf°(produits) - Σ ΔHf°(réactifs)
FAQ
-
La loi de Hess s'applique-t-elle à toutes les réactions chimiques ?
Oui, la loi de Hess est un principe général qui s'applique à toutes les réactions chimiques, qu'elles soient exothermiques ou endothermiques. -
Comment gérer les changements d'état (solide, liquide, gaz) dans les calculs utilisant la loi de Hess ?
Il faut prendre en compte les enthalpies de changement d'état (fusion, vaporisation, sublimation) dans le cycle thermochimique. Chaque changement d'état a une enthalpie associée qu'il faut ajouter ou soustraire selon le sens de la transformation.
