Physique-Chimie > Analyse Chimique (Notions) > Méthodes d'Analyse > Spectrophotométrie (principe)
Spectrophotométrie : Principe et Applications
Découvrez le principe fondamental de la spectrophotométrie, une technique d'analyse chimique essentielle pour déterminer la concentration de substances colorées en solution. Ce guide aborde les concepts clés, le fonctionnement de l'appareil et ses applications pratiques au lycée.
Qu'est-ce que la spectrophotométrie ?
La spectrophotométrie est une méthode d'analyse quantitative qui permet de mesurer l'absorbance ou la transmittance d'une solution à une longueur d'onde spécifique. En d'autres termes, elle mesure la quantité de lumière qu'une substance absorbe. Cette technique est particulièrement utile pour les substances colorées, car elles absorbent la lumière visible à certaines longueurs d'onde. Plus une solution est concentrée, plus elle absorbe de lumière.
Principe de la mesure
Le principe repose sur le fait que chaque substance chimique a une capacité unique d'absorber la lumière à différentes longueurs d'onde. Un spectrophotomètre envoie un faisceau de lumière à travers la solution à analyser. Une partie de la lumière est absorbée par la substance, et le reste est transmis. Le spectrophotomètre mesure l'intensité de la lumière transmise et la compare à l'intensité de la lumière incidente (celle envoyée initialement). La différence entre ces deux intensités donne l'absorbance.
Loi de Beer-Lambert
La relation entre l'absorbance (A), la concentration (c) de la substance et la longueur du trajet optique (l) est donnée par la loi de Beer-Lambert :
A = εcl
où :
- A est l'absorbance (sans unité)
- ε (epsilon) est l'absorptivité molaire (L mol-1 cm-1), une constante qui dépend de la substance et de la longueur d'onde
- c est la concentration de la substance (mol L-1)
- l est la longueur du trajet optique, c'est-à-dire l'épaisseur de la cuve contenant la solution (cm)
Cette loi est fondamentale car elle permet de relier l'absorbance, une grandeur mesurable expérimentalement, à la concentration de la substance, une information souvent recherchée en chimie.
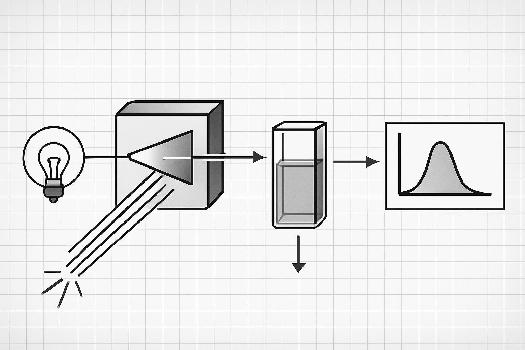
Fonctionnement d'un spectrophotomètre
Un spectrophotomètre typique comprend les éléments suivants :
- Source de lumière : Elle émet un faisceau de lumière couvrant une large gamme de longueurs d'onde (UV-Visible).
- Monochromateur : Il sélectionne une longueur d'onde spécifique du faisceau lumineux. Cela peut être un prisme, un réseau de diffraction ou un filtre.
- Cuve : Un récipient transparent (souvent en quartz ou en plastique) qui contient la solution à analyser.
- Détecteur : Il mesure l'intensité de la lumière qui a traversé la solution. Le détecteur convertit la lumière en un signal électrique.
- Affichage : Il affiche la valeur de l'absorbance ou de la transmittance.
Le spectrophotomètre compare l'intensité de la lumière incidente (I0) à l'intensité de la lumière transmise (I) après avoir traversé la solution. La transmittance (T) est définie comme le rapport I/I0. L'absorbance (A) est définie comme le logarithme décimal de l'inverse de la transmittance : A = -log10(T).
Applications au Lycée
La spectrophotométrie trouve de nombreuses applications dans les laboratoires de lycée, notamment :
- Dosage de solutions colorées : Déterminer la concentration d'une solution colorée (par exemple, une solution de permanganate de potassium ou de bleu de méthylène).
- Suivi cinétique de réactions : Mesurer la variation de la concentration d'un réactif ou d'un produit au cours du temps pour étudier la vitesse d'une réaction chimique.
- Identification de substances : Comparer le spectre d'absorption d'une substance inconnue à des spectres de référence pour l'identifier.
- Contrôle de la qualité de l'eau : Mesurer la concentration de certains polluants dans l'eau (par exemple, les nitrates ou les nitrites).
Ce qu'il faut retenir
- La spectrophotométrie est une technique d'analyse quantitative qui mesure l'absorbance ou la transmittance d'une solution.
- La loi de Beer-Lambert relie l'absorbance à la concentration et à la longueur du trajet optique : A = εcl.
- Un spectrophotomètre comprend une source de lumière, un monochromateur, une cuve, un détecteur et un afficheur.
- La spectrophotométrie a de nombreuses applications au lycée, notamment le dosage de solutions, le suivi cinétique de réactions et l'identification de substances.
FAQ
-
Quelles sont les limites de la loi de Beer-Lambert ?
La loi de Beer-Lambert n'est valable que pour des solutions diluées. À des concentrations élevées, les interactions entre les molécules de soluté peuvent affecter l'absorptivité molaire, et la loi n'est plus respectée. De plus, elle ne s'applique qu'à des solutions homogènes et non diffusantes. -
Pourquoi utilise-t-on un monochromateur ?
Le monochromateur permet de sélectionner une longueur d'onde spécifique de la lumière. Chaque substance absorbe la lumière de manière maximale à une certaine longueur d'onde. En utilisant un monochromateur, on s'assure de mesurer l'absorbance à la longueur d'onde où la substance absorbe le plus, ce qui permet d'obtenir une mesure plus précise.
