Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Atomes (noyau, électrons, protons, neutrons)
Nombre de Masse et Isotopes : Variations Atomiques
Comprendre le nombre de masse (A) et le concept d'isotopes. Explorez comment ces variations influencent les propriétés des atomes.
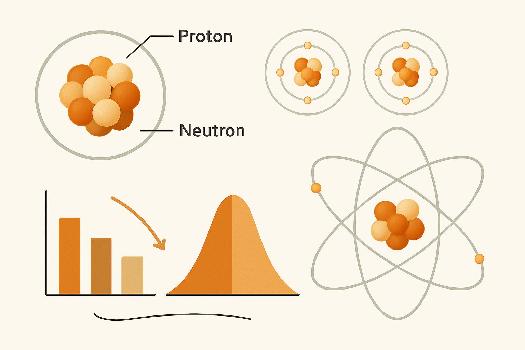
Rappel : Numéro Atomique (Z) et Nombre de Masse (A)
Avant de parler des isotopes, rappelons deux notions essentielles :
- Numéro Atomique (Z) : C'est le nombre de protons dans le noyau d'un atome. Il est unique pour chaque élément chimique et permet de l'identifier. Par exemple, tous les atomes avec Z=6 sont des atomes de carbone.
- Nombre de Masse (A) : C'est le nombre total de nucléons (protons + neutrons) dans le noyau d'un atome. A = Nombre de protons (Z) + Nombre de neutrons (N).
Le Nombre de Masse (A) en Détail
Le nombre de masse (A) est une caractéristique importante de chaque atome. Il donne une indication de la masse du noyau et, par conséquent, de la masse de l'atome (la masse des électrons étant négligeable par rapport à celle du noyau). Deux atomes du même élément (même Z) peuvent avoir des nombres de masse différents s'ils ont un nombre différent de neutrons. C'est ce qui définit les isotopes.
Les Isotopes : Des Atomes Variants
Définition : Les isotopes sont des atomes d'un même élément (même numéro atomique Z) mais ayant un nombre différent de neutrons. Ils ont donc des nombres de masse (A) différents.
Exemple : Le carbone possède plusieurs isotopes, dont le carbone-12 (12C) et le carbone-14 (14C). Ils ont tous les deux 6 protons (Z=6), mais le carbone-12 a 6 neutrons (A=12) tandis que le carbone-14 en a 8 neutrons (A=14).
Conséquences : Les isotopes ont des propriétés chimiques pratiquement identiques, car elles sont déterminées par le nombre d'électrons (qui est le même pour tous les isotopes d'un élément). Cependant, ils peuvent avoir des propriétés physiques différentes, notamment en termes de stabilité nucléaire. Certains isotopes sont stables, tandis que d'autres sont radioactifs (comme le carbone-14).
Abondance Naturelle des Isotopes
La plupart des éléments chimiques existent sous la forme d'un mélange d'isotopes dans la nature. L'abondance naturelle d'un isotope est le pourcentage de cet isotope présent dans un échantillon naturel de l'élément. Par exemple, l'abondance naturelle du carbone-12 est d'environ 98,9%, tandis que celle du carbone-13 est d'environ 1,1%. Le carbone-14 est présent en quantités infimes (traces).
Utilisations des Isotopes
Les isotopes ont de nombreuses applications dans divers domaines :
- Datation au carbone 14 : Le carbone-14, isotope radioactif, est utilisé pour dater des objets anciens (matière organique) jusqu'à environ 50 000 ans.
- Imagerie médicale : Des isotopes radioactifs sont utilisés comme traceurs pour visualiser des organes et détecter des anomalies.
- Production d'énergie : Certains isotopes sont utilisés dans les centrales nucléaires pour produire de l'énergie (fission nucléaire).
Ce qu'il faut retenir
- Nombre atomique (Z) : Nombre de protons dans le noyau (identifie l'élément).
- Nombre de masse (A) : Nombre de protons + nombre de neutrons dans le noyau.
- Isotopes : Atomes d'un même élément (même Z) avec des nombres de neutrons différents (donc des A différents).
- Les isotopes ont des propriétés chimiques similaires mais peuvent avoir des propriétés physiques différentes.
- L'abondance naturelle d'un isotope est le pourcentage de cet isotope dans un échantillon naturel.
- Les isotopes ont de nombreuses applications (datation, imagerie médicale, production d'énergie).
FAQ
-
Est-ce que tous les éléments ont des isotopes ?
Oui, presque tous les éléments ont des isotopes. Certains n'ont qu'un seul isotope stable, tandis que d'autres en ont plusieurs. -
Quelle est la différence entre un isotope stable et un isotope radioactif ?
Un isotope stable ne se désintègre pas spontanément avec le temps. Un isotope radioactif se désintègre spontanément, émettant des particules ou de l'énergie, pour se transformer en un autre noyau. -
Comment calculer le nombre de neutrons à partir du nombre de masse et du numéro atomique?
Le nombre de neutrons (N) est calculé en soustrayant le numéro atomique (Z) du nombre de masse (A): N = A - Z.
