Physique-Chimie > Chimie Organique > Nomenclature et Isomérie > Nomenclature des alcanes, alcènes, alcynes
Nomenclature des Alcanes, Alcènes et Alcynes : Guide Complet pour le Lycée
Apprenez à nommer correctement les alcanes, alcènes et alcynes grâce à ce guide détaillé. Comprenez les règles de nomenclature IUPAC et identifiez les groupes fonctionnels pour maîtriser la chimie organique.
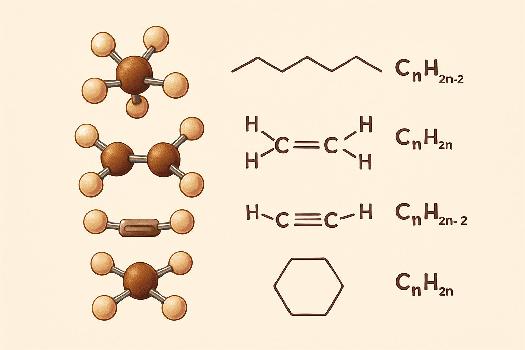
Introduction à la Nomenclature en Chimie Organique
La nomenclature en chimie organique est un système de dénomination des composés organiques basé sur des règles établies par l'IUPAC (Union Internationale de Chimie Pure et Appliquée). Elle permet de désigner de manière unique chaque molécule organique, évitant ainsi toute ambiguïté. Dans ce guide, nous allons explorer les bases de la nomenclature pour les alcanes, alcènes et alcynes, des hydrocarbures importants en chimie organique. Ces hydrocarbures sont composés uniquement de carbone et d'hydrogène.
Les Alcanes : Définition et Formule Générale
Les alcanes sont des hydrocarbures saturés, c'est-à-dire qu'ils ne contiennent que des liaisons simples carbone-carbone (C-C). Leur formule générale est CnH2n+2, où 'n' représente le nombre d'atomes de carbone dans la molécule. Par exemple, le méthane (CH4) est l'alcane le plus simple, suivi de l'éthane (C2H6), du propane (C3H8), et ainsi de suite. Il est important de comprendre que la saturation signifie que chaque atome de carbone est lié au maximum possible d'atomes d'hydrogène.
Règles de Nomenclature des Alcanes
Pour nommer un alcane, suivez ces étapes :
- Identifier la chaîne carbonée la plus longue : C'est la chaîne principale. Par exemple, si vous avez une chaîne de 5 carbones, la base du nom sera 'pentane'.
- Numéroter la chaîne principale : Commencez à numéroter l'extrémité de la chaîne la plus proche d'une ramification (substituant). L'objectif est de donner les numéros les plus petits possibles aux substituants.
- Identifier et nommer les substituants (groupes alkyles) : Les groupes alkyles sont des fragments d'alcanes qui sont liés à la chaîne principale. Ils sont nommés en remplaçant la terminaison '-ane' par '-yle'. Par exemple, CH3- est le méthyle, C2H5- est l'éthyle, etc.
- Assembler le nom : Écrivez le nom en indiquant la position des substituants (numéros) suivis de leur nom, puis le nom de la chaîne principale. S'il y a plusieurs substituants identiques, utilisez les préfixes 'di-', 'tri-', 'tétra-', etc., et indiquez la position de chaque substituant. Séparez les nombres par des virgules et les nombres des noms par des tirets.
Les Alcènes : Définition et Formule Générale
Les alcènes sont des hydrocarbures insaturés qui contiennent au moins une double liaison carbone-carbone (C=C). Leur formule générale est CnH2n, où 'n' est le nombre d'atomes de carbone. La présence d'une double liaison introduit une insaturation, ce qui signifie que la molécule pourrait potentiellement ajouter d'autres atomes. L'alcène le plus simple est l'éthène (C2H4), communément appelé éthylène.
Règles de Nomenclature des Alcènes
Pour nommer un alcène, suivez ces étapes :
- Identifier la chaîne carbonée la plus longue qui contient la double liaison : C'est la chaîne principale. Le nom de base se termine en '-ène' au lieu de '-ane'. Par exemple, une chaîne de 5 carbones avec une double liaison devient 'pentène'.
- Numéroter la chaîne principale : Commencez à numéroter l'extrémité de la chaîne la plus proche de la double liaison. La double liaison doit avoir le numéro le plus bas possible. Le numéro de la double liaison est placé juste avant le nom '-ène'.
- Identifier et nommer les substituants : Comme pour les alcanes, identifiez et nommez les groupes alkyles attachés à la chaîne principale.
- Assembler le nom : Écrivez le nom en indiquant la position des substituants (numéros) suivis de leur nom, puis le numéro de la double liaison et le nom de la chaîne principale (avec la terminaison '-ène').
Les Alcynes : Définition et Formule Générale
Les alcynes sont des hydrocarbures insaturés qui contiennent au moins une triple liaison carbone-carbone (C≡C). Leur formule générale est CnH2n-2, où 'n' est le nombre d'atomes de carbone. La triple liaison représente un degré d'insaturation encore plus élevé que la double liaison. L'alcyne le plus simple est l'éthyne (C2H2), communément appelé acétylène.
Règles de Nomenclature des Alcynes
Pour nommer un alcyne, suivez ces étapes :
- Identifier la chaîne carbonée la plus longue qui contient la triple liaison : C'est la chaîne principale. Le nom de base se termine en '-yne' au lieu de '-ane'. Par exemple, une chaîne de 5 carbones avec une triple liaison devient 'pentyne'.
- Numéroter la chaîne principale : Commencez à numéroter l'extrémité de la chaîne la plus proche de la triple liaison. La triple liaison doit avoir le numéro le plus bas possible. Le numéro de la triple liaison est placé juste avant le nom '-yne'.
- Identifier et nommer les substituants : Comme pour les alcanes et les alcènes, identifiez et nommez les groupes alkyles attachés à la chaîne principale.
- Assembler le nom : Écrivez le nom en indiquant la position des substituants (numéros) suivis de leur nom, puis le numéro de la triple liaison et le nom de la chaîne principale (avec la terminaison '-yne').
Exemples Complémentaires et Cas Particuliers
Alcanes cycliques : Les alcanes cycliques sont des alcanes dont les atomes de carbone forment un cycle. On ajoute le préfixe 'cyclo-' devant le nom de l'alcane correspondant. Par exemple, le cyclohexane est un cycle de six atomes de carbone. S'il y a des substituants, numérotez le cycle de manière à ce que les substituants aient les numéros les plus bas possibles. Composés avec plusieurs insaturations : S'il y a plusieurs doubles liaisons (alcadiènes, alcatriènes, etc.) ou plusieurs triples liaisons (diynes, triynes, etc.), utilisez les préfixes 'di-', 'tri-', etc. devant la terminaison '-ène' ou '-yne'. Indiquez la position de chaque double ou triple liaison. Exemple : Buta-1,3-diène (deux doubles liaisons entre les atomes de carbone 1-2 et 3-4 d'une chaîne de quatre carbones). Présence de fonctions autres qu'alcane, alcène ou alcyne : Si d'autres groupes fonctionnels sont présents (alcools, acides carboxyliques, etc.), ils ont priorité dans la nomenclature. Consultez les règles de nomenclature IUPAC spécifiques pour ces fonctions.
Ce qu'il faut retenir
- Alcanes : Hydrocarbures saturés (liaisons simples C-C), formule générale CnH2n+2. Terminaison '-ane'.
- Alcènes : Hydrocarbures insaturés (au moins une double liaison C=C), formule générale CnH2n. Terminaison '-ène'. Numéroter la chaîne pour donner le plus petit numéro à la double liaison.
- Alcynes : Hydrocarbures insaturés (au moins une triple liaison C≡C), formule générale CnH2n-2. Terminaison '-yne'. Numéroter la chaîne pour donner le plus petit numéro à la triple liaison.
- Règles IUPAC : Identifier la chaîne la plus longue contenant l'insaturation (double ou triple liaison), numéroter la chaîne pour donner les plus petits numéros aux substituants et aux insaturations, nommer les substituants et assembler le nom complet.
- Alcanes cycliques : Préfixe 'cyclo-' devant le nom de l'alcane.
FAQ
-
Comment savoir si une molécule est un alcane, un alcène ou un alcyne?
Regardez les liaisons entre les atomes de carbone. Si toutes les liaisons sont simples, c'est un alcane. S'il y a au moins une double liaison, c'est un alcène. S'il y a au moins une triple liaison, c'est un alcyne. -
Que faire s'il y a plusieurs substituants sur la chaîne principale?
Numérotez la chaîne de façon à ce que les substituants aient les numéros les plus bas possibles. Nommez les substituants par ordre alphabétique, en utilisant les préfixes 'di-', 'tri-', etc. si plusieurs substituants sont identiques. -
Pourquoi la nomenclature est-elle importante?
La nomenclature permet d'éviter toute ambiguïté dans la désignation des molécules organiques. Elle est essentielle pour la communication scientifique et la compréhension des réactions chimiques.
