Physique-Chimie > Chimie - La Matière et ses Transformations > Transformations Physiques > Changements d'état (solide, liquide, gazeux)
Changements d'état : du solide au gaz, tout comprendre !
Explorez les changements d'état de la matière (solide, liquide, gazeux) avec des explications claires, des exemples concrets et des réponses à vos questions. Parfait pour les élèves de lycée !
Introduction aux changements d'état
La matière qui nous entoure se présente sous trois états principaux : solide, liquide et gazeux. Chaque état possède des propriétés distinctes en termes de volume, de forme et de compressibilité.
Un changement d'état est la transformation d'un état de la matière à un autre. Ces transformations sont des transformations physiques car elles modifient l'apparence physique de la substance, mais ne changent pas sa composition chimique. L'eau reste de l'eau, qu'elle soit sous forme de glace, d'eau liquide ou de vapeur.
Les différents changements d'état
Voici les principaux changements d'état, avec leur nom et les conditions nécessaires à leur réalisation :
- Fusion : Passage de l'état solide à l'état liquide. Nécessite un apport de chaleur (augmentation de la température). Exemple : la fonte de la glace.
- Solidification : Passage de l'état liquide à l'état solide. Nécessite un refroidissement (diminution de la température). Exemple : la congélation de l'eau.
- Vaporisation : Passage de l'état liquide à l'état gazeux. Il existe deux types de vaporisation :
- Évaporation : Vaporisation lente et superficielle, se produisant à toutes températures. Exemple : le séchage du linge.
- Ébullition : Vaporisation rapide et intense, se produisant à une température précise (point d'ébullition). Exemple : l'eau qui bout.
- Condensation (ou liquéfaction) : Passage de l'état gazeux à l'état liquide. Nécessite un refroidissement. Exemple : la formation de buée sur un miroir froid.
- Sublimation : Passage direct de l'état solide à l'état gazeux, sans passer par l'état liquide. Nécessite un apport de chaleur. Exemple : la sublimation de la glace carbonique (dioxyde de carbone solide).
- Condensation solide (ou déposition) : Passage direct de l'état gazeux à l'état solide, sans passer par l'état liquide. Nécessite un refroidissement. Exemple : la formation de givre.
Facteurs influençant les changements d'état
Plusieurs facteurs peuvent influencer les températures de changement d'état d'une substance :
- La pression : L'augmentation de la pression augmente généralement le point d'ébullition et diminue le point de fusion.
- Les impuretés : La présence d'impuretés peut modifier les points de fusion et d'ébullition. Par exemple, l'eau salée bout à une température plus élevée que l'eau pure.
Changements d'état et énergie
Les changements d'état impliquent un échange d'énergie thermique avec l'environnement :
- Changements d'état endothermiques : Absorption de chaleur (fusion, vaporisation, sublimation). L'énergie est nécessaire pour briser les liaisons intermoléculaires.
- Changements d'état exothermiques : Libération de chaleur (solidification, condensation, condensation solide). L'énergie est libérée lors de la formation de nouvelles liaisons intermoléculaires.
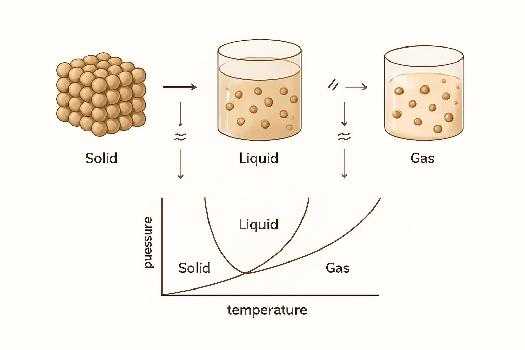
Diagramme de changement d'état
Un diagramme de changement d'état permet de visualiser les états physiques d'une substance en fonction de la température et de la pression. Il permet de déterminer quel état est stable dans des conditions données.
Point triple : Le point où les trois états (solide, liquide, gaz) coexistent en équilibre.
Point critique : Au-delà de ce point, il n'y a plus de distinction claire entre le liquide et le gaz. On parle de fluide supercritique.
Ce qu'il faut retenir
- Les changements d'état sont des transformations physiques réversibles.
- Les principaux changements d'état sont la fusion, la solidification, la vaporisation, la condensation, la sublimation et la condensation solide.
- La température et la pression influencent les changements d'état.
- Les changements d'état impliquent un échange d'énergie thermique : endothermique (absorption de chaleur) ou exothermique (libération de chaleur).
- Un diagramme de changement d'état permet de visualiser les états physiques d'une substance en fonction de la température et de la pression.
FAQ
-
Pourquoi la température reste-t-elle constante pendant un changement d'état ?
L'énergie thermique fournie (ou retirée) pendant un changement d'état est utilisée pour briser (ou former) les liaisons intermoléculaires, et non pour augmenter (ou diminuer) l'énergie cinétique des molécules, ce qui se traduirait par une variation de température. -
Quelle est la différence entre l'ébullition et l'évaporation ?
L'ébullition est un processus de vaporisation rapide qui se produit à une température spécifique (point d'ébullition), tandis que l'évaporation est un processus lent qui se produit à toutes températures à la surface du liquide.
