Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Acides et Bases > Solutions tampons (notions)
Solutions Tampons : Introduction et Applications
Découvrez les solutions tampons, leur rôle essentiel dans le maintien du pH, et comment elles fonctionnent. Comprenez les équilibres acido-basiques impliqués et leurs applications concrètes.
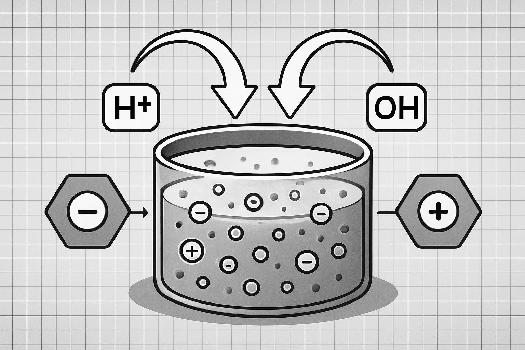
Qu'est-ce qu'une solution tampon ?
Une solution tampon est une solution aqueuse qui résiste aux changements de pH lorsqu'on lui ajoute de petites quantités d'acide ou de base forts. Elle permet de maintenir le pH d'une solution relativement constant. Les solutions tampons sont cruciales dans de nombreux processus biologiques et chimiques, car de nombreuses réactions nécessitent un pH stable pour se dérouler correctement.
Composition d'une solution tampon
Une solution tampon est généralement constituée de deux composants principaux en équilibre :
- Un acide faible et sa base conjuguée (sel de cet acide). Par exemple, l'acide acétique (CH3COOH) et l'acétate de sodium (CH3COONa).
- Une base faible et son acide conjugué (sel de cette base). Par exemple, l'ammoniac (NH3) et le chlorure d'ammonium (NH4Cl).
Mécanisme d'action d'une solution tampon
Voici comment une solution tampon agit lorsqu'on lui ajoute un acide fort ou une base forte :
- Ajout d'un acide fort (H+) : La base conjuguée de la solution tampon réagit avec l'acide ajouté, le neutralisant. Par exemple, si on ajoute de l'acide chlorhydrique (HCl) à une solution tampon composée d'acide acétique et d'acétate, l'ion acétate (CH3COO-) réagira avec les ions H+ pour former de l'acide acétique (CH3COOH).
- Ajout d'une base forte (OH-) : L'acide faible de la solution tampon réagit avec la base ajoutée, la neutralisant. Dans le même exemple, si on ajoute de l'hydroxyde de sodium (NaOH) à la solution tampon, l'acide acétique (CH3COOH) réagira avec les ions OH- pour former de l'ion acétate (CH3COO-) et de l'eau (H2O).
Calcul du pH d'une solution tampon : Équation de Henderson-Hasselbalch
L'équation de Henderson-Hasselbalch est utilisée pour calculer le pH d'une solution tampon. Elle relie le pH au pKa de l'acide faible et aux concentrations de l'acide faible et de sa base conjuguée :
- pH est le pH de la solution.
- pKa est le logarithme négatif de la constante d'acidité (Ka) de l'acide faible (pKa = -log(Ka)).
- [Base conjuguée] est la concentration de la base conjuguée.
- [Acide faible] est la concentration de l'acide faible.
Exemple concret : Préparation d'une solution tampon acétate
Supposons que vous devez préparer une solution tampon acétate avec un pH de 4.76. L'acide acétique a un pKa de 4.76. 1. Choisir les composants : Vous utilisez l'acide acétique (CH3COOH) et l'acétate de sodium (CH3COONa). 2. Appliquer l'équation de Henderson-Hasselbalch : Puisque le pH souhaité est égal au pKa, le rapport [Base conjuguée] / [Acide faible] doit être égal à 1 (log(1) = 0). Cela signifie que les concentrations de l'acide acétique et de l'acétate de sodium doivent être égales. 3. Préparation de la solution : Vous dissoudre des quantités égales d'acide acétique et d'acétate de sodium dans de l'eau jusqu'à obtenir la concentration désirée. Par exemple, vous pouvez dissoudre 0.1 mole d'acide acétique et 0.1 mole d'acétate de sodium dans 1 litre d'eau. 4. Vérification du pH : Utilisez un pH-mètre pour vérifier que le pH de la solution est bien de 4.76. Si nécessaire, ajustez légèrement les concentrations d'acide acétique ou d'acétate de sodium pour atteindre le pH souhaité.
Applications des solutions tampons
Les solutions tampons ont de nombreuses applications dans différents domaines :
- Biologie et Biochimie : Elles sont utilisées pour maintenir le pH dans les milieux de culture cellulaire, les réactions enzymatiques et les analyses biologiques. Le sang, par exemple, possède un système tampon complexe (bicarbonate, phosphate) pour maintenir un pH stable autour de 7.4.
- Chimie analytique : Elles sont utilisées pour calibrer les pH-mètres et pour contrôler le pH des réactions chimiques.
- Industrie pharmaceutique : Elles sont utilisées dans la formulation de médicaments pour assurer leur stabilité et leur efficacité.
- Industrie alimentaire : Elles sont utilisées pour contrôler le pH des aliments et des boissons.
Ce qu'il faut retenir
- Définition : Une solution tampon résiste aux variations de pH lors de l'ajout d'acide ou de base.
- Composition : Un acide faible et sa base conjuguée, ou une base faible et son acide conjugué.
- Mécanisme : Neutralisation des ions H+ ou OH- ajoutés.
- Équation de Henderson-Hasselbalch : pH = pKa + log ([Base conjuguée] / [Acide faible]).
- Applications : Biologie, chimie, industrie pharmaceutique, industrie alimentaire.
FAQ
-
Pourquoi est-il important de maintenir un pH stable dans les systèmes biologiques ?
Le pH influence l'activité des enzymes et la structure des protéines. Des variations de pH peuvent dénaturer les protéines et inhiber les réactions enzymatiques, ce qui perturbe les processus biologiques. -
Comment choisir une solution tampon adaptée à une expérience ?
Il faut choisir une solution tampon dont le pKa est proche du pH souhaité pour l'expérience. L'équation de Henderson-Hasselbalch permet de calculer les concentrations nécessaires des composants de la solution tampon. -
Qu'arrive-t-il si on ajoute une grande quantité d'acide ou de base à une solution tampon ?
La solution tampon a une capacité limitée. Si on ajoute une quantité excessive d'acide ou de base, la capacité tampon est dépassée, et le pH de la solution changera significativement. On dit alors que la solution est 'débordée'.
