Physique-Chimie > Chimie - Thermochimie (Notions) > Énergie et Réactions Chimiques > Loi de Hess (notions)
Exercice d'application : Calcul d'enthalpie de formation avec la loi de Hess
Un exercice détaillé pour appliquer la loi de Hess et calculer l'enthalpie de formation d'un composé à partir de données expérimentales.
Énoncé du problème
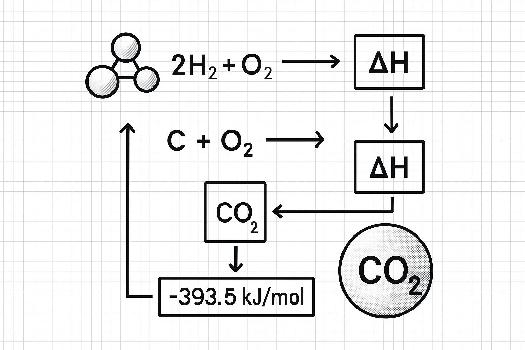
Problème: Calculer l'enthalpie de formation standard du dioxyde de carbone (CO2(g)) à partir des données suivantes :
- C(s) + O2(g) → CO2(g) ΔH1 = -393.5 kJ/mol
- C(s) + 1/2 O2(g) → CO(g) ΔH2 = -110.5 kJ/mol
- CO(g) + 1/2 O2(g) → CO2(g) ΔH3 = -283.0 kJ/mol
Stratégie de résolution
Objectif : Déterminer l'enthalpie de la réaction de formation de CO2(g) à partir de ses éléments dans leur état standard, c'est-à-dire le carbone solide (C(s)) et le dioxygène gazeux (O2(g)). Cette réaction est déjà donnée directement dans l'énoncé (première équation). Le but est donc de vérifier que l'on comprend l'application de la loi de Hess.
Méthode : Utiliser les réactions intermédiaires données et la loi de Hess pour calculer l'enthalpie de formation de CO2(g). On va vérifier que, quelle que soit la méthode utilisée, on arrive bien au même résultat.
Solution détaillée
Analyse des données : On remarque que la réaction (1) est directement la réaction de formation du CO2 à partir de ses éléments. Donc, ΔHf°(CO2) = ΔH1 = -393.5 kJ/mol.
On peut également arriver à ce résultat par un chemin indirect. On peut considérer que la formation de CO2 se fait en deux étapes : d'abord la formation de CO, puis la combustion de CO en CO2.
Application de la loi de Hess :
On peut écrire : ΔH1 = ΔH2 + ΔH3
En remplaçant par les valeurs : -393.5 kJ/mol = -110.5 kJ/mol + (-283.0 kJ/mol)
Ce qui est bien vérifié.
Conclusion : L'enthalpie de formation standard du dioxyde de carbone est de -393.5 kJ/mol.
Interprétation des résultats
La valeur négative de l'enthalpie de formation indique que la formation de CO2(g) à partir de ses éléments est une réaction exothermique. Cela signifie qu'elle libère de la chaleur. Ce résultat est cohérent avec l'expérience et confirme l'exactitude de la loi de Hess et son application.
Ce qu'il faut retenir
- La loi de Hess permet de calculer des enthalpies de réaction indirectement.
- Bien identifier la réaction cible et les réactions intermédiaires est crucial.
- L'enthalpie de formation standard du CO2 est de -393.5 kJ/mol.
FAQ
-
Est-ce que la loi de Hess peut être utilisée pour des réactions en phase aqueuse ?
Oui, la loi de Hess s'applique également aux réactions en phase aqueuse. Il faut juste tenir compte des enthalpies de dissolution et de solvatation si elles sont significatives. -
Comment prendre en compte les changements de température dans les calculs avec la loi de Hess ?
La loi de Hess est rigoureusement valable à température constante. Pour des variations de température importantes, il faut utiliser les capacités calorifiques des réactifs et des produits pour corriger les enthalpies.
