Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Molécules (liaisons chimiques : ionique, covalente)
Les Liaisons Chimiques : Ioniques et Covalentes
Explorez en détail les liaisons chimiques ioniques et covalentes, les forces qui unissent les atomes pour former des molécules. Découvrez leurs propriétés, leurs différences et comment prédire le type de liaison en fonction des atomes impliqués. Ce guide complet est conçu pour les élèves de lycée.
Introduction aux Liaisons Chimiques
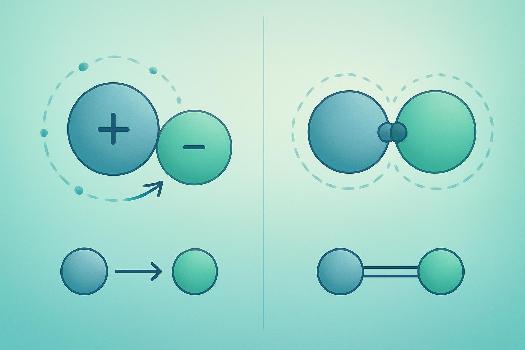
Les atomes ne sont généralement pas stables seuls et ont tendance à se lier à d'autres atomes pour former des molécules ou des réseaux cristallins. Cette liaison se fait grâce à des forces électrostatiques. Deux types principaux de liaisons sont à considérer : les liaisons ioniques et les liaisons covalentes. Comprendre ces liaisons est essentiel pour appréhender la structure et les propriétés des différentes substances chimiques.
La Liaison Ionique : Transfert d'Électrons
La liaison ionique se forme lorsque des atomes transfèrent complètement des électrons entre eux. Généralement, un atome de métal cède un ou plusieurs électrons à un atome non métallique.
Processus :
- Transfert d'électrons : Un atome (généralement un métal) perd des électrons pour devenir un ion positif (cation). L'autre atome (généralement un non-métal) gagne ces électrons pour devenir un ion négatif (anion).
- Attraction électrostatique : Les ions de charges opposées s'attirent mutuellement en raison de la force électrostatique. Cette attraction forme une liaison ionique.
Exemple : Le chlorure de sodium (NaCl), le sel de table. Le sodium (Na) cède un électron au chlore (Cl). Na devient Na+ et Cl devient Cl-. L'attraction entre ces ions forme la liaison ionique.
Propriétés des Composés Ioniques
Les composés ioniques présentent plusieurs propriétés caractéristiques, conséquence de la forte attraction électrostatique entre les ions :
- Points de fusion et d'ébullition élevés : Il faut beaucoup d'énergie pour briser les fortes liaisons ioniques.
- Solubilité dans l'eau : Beaucoup de composés ioniques se dissolvent bien dans l'eau, car les molécules d'eau polaires peuvent solvater les ions.
- Conductivité électrique à l'état fondu ou en solution : Les ions peuvent se déplacer librement et conduire le courant électrique lorsqu'ils sont dissous dans l'eau ou fondus.
- Dureté et fragilité : Les composés ioniques sont souvent durs mais cassants. Une petite déformation peut entraîner une répulsion entre les ions de même charge, provoquant la rupture du cristal.
La Liaison Covalente : Partage d'Électrons
La liaison covalente se forme lorsque des atomes partagent des électrons pour atteindre une configuration électronique stable. Ce type de liaison est fréquent entre deux atomes non métalliques.
Processus :
- Partage d'électrons : Les atomes mettent en commun des électrons de valence pour créer des paires d'électrons partagés. Chaque atome contribue un nombre d'électrons pour atteindre une configuration stable (souvent la règle de l'octet).
- Attraction nucléaire : Les noyaux des atomes sont attirés par les électrons partagés, ce qui maintient la liaison covalente.
Exemple : La molécule de méthane (CH4). L'atome de carbone (C) partage quatre électrons avec quatre atomes d'hydrogène (H). Chaque atome d'hydrogène partage un électron avec le carbone. Ainsi, le carbone atteint un octet (8 électrons dans sa couche externe) et chaque hydrogène a deux électrons (comme l'hélium).
Types de Liaisons Covalentes
Il existe différents types de liaisons covalentes, selon le nombre de paires d'électrons partagées :
- Liaison simple : Une paire d'électrons est partagée (ex : H-H dans H2).
- Liaison double : Deux paires d'électrons sont partagées (ex : O=O dans O2).
- Liaison triple : Trois paires d'électrons sont partagées (ex : N≡N dans N2).
Polarité des Liaisons Covalentes
La liaison covalente peut être polaire ou non polaire, selon l'électronégativité des atomes impliqués.
- Liaison covalente non polaire : Les électrons sont partagés équitablement entre les atomes (ex : H-H). Cela se produit lorsque les atomes ont la même électronégativité.
- Liaison covalente polaire : Les électrons sont partagés inégalement entre les atomes (ex : H-Cl). Cela se produit lorsque les atomes ont des électronégativités différentes. L'atome le plus électronégatif attire davantage les électrons, ce qui crée une charge partielle négative (δ-) sur cet atome et une charge partielle positive (δ+) sur l'autre.
Comparaison : Liaisons Ioniques vs. Liaisons Covalentes
Voici un tableau comparatif pour résumer les différences entre les liaisons ioniques et covalentes:
| Caractéristique | Liaison Ionique | Liaison Covalente |
|---|---|---|
| Formation | Transfert d'électrons | Partage d'électrons |
| Type d'atomes | Métal et non-métal | Non-métaux |
| Force | Forte | Variable (faible à forte) |
| Points de fusion/ébullition | Élevés | Variables (bas à élevés) |
| Conductivité | Conducteurs à l'état fondu ou en solution | Non conducteurs (sauf exceptions) |
Ce qu'il faut retenir
- Liaison ionique : Transfert d'électrons entre un métal et un non-métal, formant des ions de charges opposées qui s'attirent. Composés avec points de fusion/ébullition élevés, conductivité en solution, et souvent solubles dans l'eau.
- Liaison covalente : Partage d'électrons entre deux non-métaux. Peut être simple, double ou triple.
- Polarité des liaisons covalentes : Non polaire (partage égal) ou polaire (partage inégal dû à des différences d'électronégativité).
- Les liaisons ioniques et covalentes sont les forces fondamentales qui maintiennent les atomes ensemble pour former des molécules et des composés. Le type de liaison influence grandement les propriétés physiques et chimiques des substances.
FAQ
-
Comment savoir si une liaison est ionique ou covalente ?
Généralement, si la liaison se forme entre un métal et un non-métal, elle est ionique. Si elle se forme entre deux non-métaux, elle est covalente. La différence d'électronégativité entre les atomes peut aussi être un indicateur. Une grande différence suggère une liaison ionique, tandis qu'une petite différence suggère une liaison covalente. -
Qu'est-ce que l'électronégativité ?
L'électronégativité est la capacité d'un atome à attirer les électrons dans une liaison chimique. Plus un atome est électronégatif, plus il attire les électrons vers lui. Elle est utilisée pour prédire la polarité d'une liaison covalente.
