Physique-Chimie > Analyse Chimique (Notions) > Méthodes d'Analyse > Titrage
Titrage Acide-Base: Comprendre et Maîtriser
Ce guide complet vous explique en détail le titrage acide-base, une technique essentielle en chimie analytique. Découvrez les principes fondamentaux, les étapes clés et les applications pratiques du titrage, avec des exemples concrets et des illustrations pour une compréhension optimale.
Introduction au Titrage Acide-Base
Le titrage acide-base, aussi appelé dosage acido-basique, est une méthode quantitative utilisée pour déterminer la concentration d'une solution acide ou basique. Il repose sur la réaction de neutralisation entre un acide et une base.
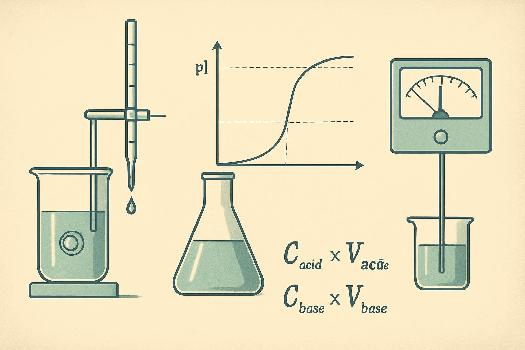
Principe fondamental: On ajoute progressivement une solution de concentration connue (le titrant) à une solution de concentration inconnue (l'analyte) jusqu'à ce que la réaction de neutralisation soit complète. Le point où la réaction est complète est appelé le point d'équivalence.
Pour visualiser ce point d'équivalence, on utilise généralement un indicateur coloré qui change de couleur à un pH spécifique ou un pH-mètre pour mesurer directement le pH de la solution.
Le Matériel Nécessaire pour un Titrage
Pour réaliser un titrage précis, vous aurez besoin du matériel suivant:
- Une burette: Un tube gradué avec un robinet permettant de verser le titrant goutte à goutte. Elle est essentielle pour contrôler précisément le volume de titrant ajouté.
- Un erlenmeyer ou bécher: Pour contenir l'analyte. Il est important de pouvoir agiter la solution.
- Un agitateur magnétique et un barreau aimanté: Pour assurer un mélange homogène pendant le titrage, ce qui favorise une réaction complète et rapide.
- Un indicateur coloré: Une substance qui change de couleur en fonction du pH de la solution. Le choix de l'indicateur est crucial pour visualiser correctement le point d'équivalence. Exemples courants: phénolphtaléine, hélianthine, bleu de bromothymol.
- OU un pH-mètre: Un instrument de mesure du pH qui donne une lecture numérique précise. Il est plus précis que l'utilisation d'un indicateur.
- Une solution titrante (standard): Une solution de concentration connue avec précision. Elle est préparée avec une substance pure et séchée.
- Une solution à titrer (analyte): La solution dont on veut déterminer la concentration.
Procédure de Titrage: Étape par Étape
Voici les étapes à suivre pour réaliser un titrage acide-base:
- Préparation du matériel: Rincer la burette avec la solution titrante et l'erlenmeyer avec de l'eau distillée.
- Remplissage de la burette: Remplir la burette avec la solution titrante et ajuster le niveau à zéro. Éliminer les bulles d'air éventuelles.
- Préparation de l'analyte: Pipetter un volume connu de l'analyte dans l'erlenmeyer. Ajouter quelques gouttes d'indicateur coloré (si vous n'utilisez pas de pH-mètre).
- Titrage: Ajouter lentement la solution titrante à l'analyte, en agitant constamment l'erlenmeyer (ou en utilisant l'agitateur magnétique).
- Approche du point d'équivalence: Ralentir l'ajout de la solution titrante lorsque l'on approche du point d'équivalence (changement de couleur de l'indicateur ou variation rapide du pH). Ajouter la solution titrante goutte à goutte.
- Atteinte du point d'équivalence: Arrêter l'ajout de la solution titrante lorsque l'indicateur change de couleur de façon persistante (ou lorsque le pH atteint la valeur attendue).
- Lecture du volume: Noter le volume de solution titrante ajouté.
- Répétition: Répéter le titrage au moins trois fois pour obtenir des résultats précis et fiables.
Calcul de la Concentration
Au point d'équivalence, le nombre de moles d'acide est égal au nombre de moles de base.
On peut utiliser la formule suivante:
nacide = nbase
Où n représente le nombre de moles.
Sachant que n = C * V, où C est la concentration et V est le volume, on a:
Cacide * Vacide = Cbase * Vbase
Si on connaît trois de ces valeurs, on peut calculer la quatrième. Par exemple, si on connaît Cbase, Vbase et Vacide, on peut calculer Cacide:
Cacide = (Cbase * Vbase) / Vacide
Important: Assurez-vous que les volumes sont exprimés dans les mêmes unités (par exemple, en litres ou en millilitres). La concentration est généralement exprimée en mol/L (mol par litre).
Exemple Concret
On titre 25.0 mL d'une solution d'acide chlorhydrique (HCl) de concentration inconnue avec une solution d'hydroxyde de sodium (NaOH) à 0.100 mol/L. Le point d'équivalence est atteint après l'ajout de 20.0 mL de NaOH. Quelle est la concentration de la solution d'HCl?
Réponse:
On utilise la formule: Cacide * Vacide = Cbase * Vbase
On a: Cbase = 0.100 mol/L, Vbase = 20.0 mL, Vacide = 25.0 mL.
On cherche Cacide.
Cacide = (Cbase * Vbase) / Vacide = (0.100 mol/L * 20.0 mL) / 25.0 mL = 0.0800 mol/L
La concentration de la solution d'HCl est donc de 0.0800 mol/L.
Ce qu'il faut retenir
- Le titrage acide-base est une méthode quantitative pour déterminer la concentration d'un acide ou d'une base inconnue.
- Il repose sur la réaction de neutralisation entre un acide et une base.
- Le point d'équivalence est atteint lorsque le nombre de moles d'acide est égal au nombre de moles de base.
- On utilise un indicateur coloré ou un pH-mètre pour visualiser le point d'équivalence.
- La formule Cacide * Vacide = Cbase * Vbase permet de calculer la concentration inconnue.
- La précision du titrage dépend de la qualité du matériel, de la technique utilisée et du choix de l'indicateur.
FAQ
-
Pourquoi faut-il rincer la burette avec la solution titrante avant de commencer le titrage?
Le rinçage de la burette avec la solution titrante permet d'éliminer toute trace d'eau ou d'autres impuretés qui pourraient diluer la solution titrante et affecter la précision du titrage. -
Comment choisir l'indicateur coloré approprié pour un titrage?
L'indicateur coloré doit être choisi de manière à ce que sa zone de virage (la gamme de pH où il change de couleur) corresponde au pH au point d'équivalence du titrage. Si le pH au point d'équivalence est acide, on choisira un indicateur qui vire en milieu acide. Si le pH est basique, on choisira un indicateur qui vire en milieu basique. -
Qu'est-ce qu'une erreur de titrage?
L'erreur de titrage est la différence entre le point d'équivalence théorique et le point final observé (le moment où l'indicateur change de couleur). Elle peut être due à une mauvaise lecture du volume, à un choix inapproprié de l'indicateur, ou à d'autres facteurs.
