Physique-Chimie > Chimie - La Matière et ses Transformations > Réactions Chimiques > Dilution
La Dilution : Comprendre et Maîtriser le Concept
La dilution est une technique fondamentale en chimie. Ce guide explique en détail le processus de dilution, les calculs associés, et les applications pratiques pour les élèves de lycée.
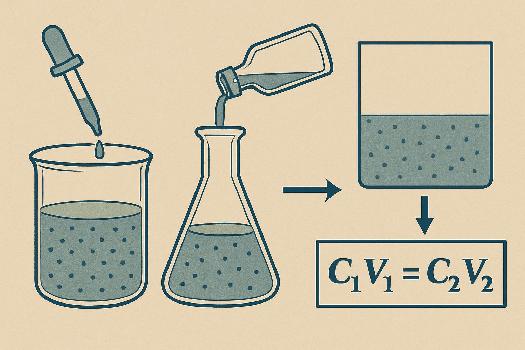
Introduction à la Dilution
La dilution est le processus qui consiste à diminuer la concentration d'une solution en y ajoutant du solvant, généralement de l'eau. L'objectif est d'obtenir une solution moins concentrée à partir d'une solution mère plus concentrée. C'est une opération courante en laboratoire et dans l'industrie.
Le Principe de Conservation de la Matière
Lors d'une dilution, la quantité de soluté (la substance que l'on dissout) reste constante. Seul le volume de la solution augmente. Ce principe est essentiel pour comprendre les calculs de dilution.
On peut donc écrire :
Nombre de moles de soluté avant dilution = Nombre de moles de soluté après dilution
La Formule de Dilution
La formule clé pour les dilutions est basée sur le principe de conservation de la matière. Elle relie la concentration et le volume de la solution avant et après dilution :
C1V1 = C2V2
Où :
- C1 est la concentration de la solution mère (avant dilution).
- V1 est le volume de la solution mère prélevé pour la dilution.
- C2 est la concentration de la solution fille (après dilution).
- V2 est le volume total de la solution fille.
Il est crucial d'utiliser les mêmes unités de volume pour V1 et V2 (par exemple, litres ou millilitres) et les mêmes unités de concentration pour C1 et C2 (par exemple, mol/L).
Exemple de Calcul de Dilution
Supposons que vous ayez une solution de chlorure de sodium (NaCl) à 1 mol/L et que vous souhaitiez préparer 100 mL d'une solution à 0.1 mol/L. Quel volume de la solution mère devez-vous prélever ?
Utilisons la formule : C1V1 = C2V2
- C1 = 1 mol/L
- V1 = ?
- C2 = 0.1 mol/L
- V2 = 100 mL
Donc, V1 = (C2V2) / C1 = (0.1 mol/L * 100 mL) / 1 mol/L = 10 mL
Vous devez donc prélever 10 mL de la solution mère et les ajouter à 90 mL de solvant (généralement de l'eau) pour obtenir 100 mL d'une solution à 0.1 mol/L.
Protocole Expérimental de Dilution
Voici un protocole général pour effectuer une dilution en laboratoire :
- Calculer le volume de solution mère nécessaire à l'aide de la formule de dilution.
- Prélever avec précision le volume calculé de la solution mère à l'aide d'une pipette graduée ou d'une burette.
- Introduire le volume prélevé dans une fiole jaugée.
- Ajouter du solvant (généralement de l'eau distillée) jusqu'à ce que le niveau atteigne le trait de jauge de la fiole.
- Homogénéiser la solution en agitant doucement la fiole.
Facteur de Dilution
Le facteur de dilution (F) est le rapport entre la concentration de la solution mère (avant dilution) et la concentration de la solution fille (après dilution). Il peut aussi être exprimé comme le rapport entre le volume final et le volume initial :
F = C1 / C2 = V2 / V1
Par exemple, si vous diluez une solution par un facteur de 10, cela signifie que la concentration de la solution fille est 10 fois inférieure à celle de la solution mère.
Précautions à Prendre
- Utiliser du matériel de verrerie propre et sec pour éviter toute contamination.
- Mesurer les volumes avec précision à l'aide de pipettes graduées ou de fioles jaugées.
- Bien homogénéiser la solution après la dilution.
- Tenir compte de la température, car elle peut affecter le volume des liquides.
Ce qu'il faut retenir
- La dilution consiste à diminuer la concentration d'une solution en ajoutant du solvant.
- La quantité de soluté reste constante lors d'une dilution.
- La formule de dilution est : C1V1 = C2V2.
- Le facteur de dilution (F) est le rapport entre les concentrations ou les volumes : F = C1 / C2 = V2 / V1.
- Il est crucial de suivre un protocole précis et de prendre des précautions pour obtenir des résultats fiables.
FAQ
-
Pourquoi est-il important d'utiliser des fioles jaugées pour les dilutions précises ?
Les fioles jaugées sont conçues pour contenir un volume précis à une température donnée. Elles permettent d'obtenir une concentration exacte de la solution diluée, ce qui est essentiel pour les expériences nécessitant une grande précision. -
Que se passe-t-il si on ajoute trop de solvant lors d'une dilution ?
Si on ajoute trop de solvant, la concentration de la solution sera plus faible que prévue. Il sera nécessaire de recommencer la dilution en utilisant une nouvelle quantité de solution mère et en ajustant le volume de solvant. -
Peut-on diluer n'importe quelle solution ?
Oui, on peut diluer n'importe quelle solution, mais il est important de tenir compte de la solubilité du soluté. Si la concentration de la solution mère est trop élevée, la dilution peut entraîner la précipitation du soluté.
