Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Tableau périodique des éléments (organisation, propriétés périodiques)
Configuration électronique et le tableau périodique
Comprendre le lien entre la configuration électronique d'un atome et sa position dans le tableau périodique, et comment cela influence ses propriétés chimiques.
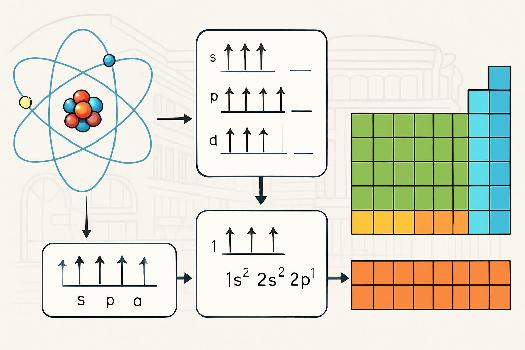
Introduction à la configuration électronique
La configuration électronique d'un atome décrit la distribution des électrons dans les différentes orbitales atomiques (s, p, d, f). Chaque orbitale peut contenir un nombre limité d'électrons (2 pour s, 6 pour p, 10 pour d, 14 pour f). La configuration électronique d'un élément détermine en grande partie ses propriétés chimiques. On utilise le principe de remplissage de Aufbau pour déterminer la configuration électronique d'un atome dans son état fondamental : les électrons remplissent les orbitales d'énergie inférieure avant de passer aux orbitales d'énergie supérieure.
Notation de la configuration électronique
On utilise une notation spécifique pour représenter la configuration électronique. Par exemple, la configuration électronique de l'hydrogène (H, Z=1) est 1s1, ce qui signifie qu'il a un électron dans l'orbitale 1s. La configuration électronique du sodium (Na, Z=11) est 1s22s22p63s1. On peut aussi utiliser une notation condensée en utilisant le gaz noble précédent comme référence. Par exemple, la configuration électronique du sodium peut aussi être écrite [Ne]3s1 où [Ne] représente la configuration électronique du néon (1s22s22p6).
Lien entre la configuration électronique et le tableau périodique
La position d'un élément dans le tableau périodique est directement liée à sa configuration électronique de valence. Les éléments du même groupe ont la même configuration électronique de valence et donc des propriétés chimiques similaires.
- Bloc s : Groupes 1 et 2 (métaux alcalins et alcalino-terreux). La couche de valence a la configuration générale ns1-2.
- Bloc p : Groupes 13 à 18 (y compris les halogènes et les gaz nobles). La couche de valence a la configuration générale ns2np1-6.
- Bloc d : Métaux de transition (groupes 3 à 12). Les électrons remplissent les orbitales d (n-1)d.
- Bloc f : Lanthanides et actinides. Les électrons remplissent les orbitales f (n-2)f.
Règle de Hund et exceptions
La règle de Hund stipule que, lorsqu'on remplit des orbitales de même énergie (par exemple, les trois orbitales p), les électrons se distribuent de manière à maximiser le nombre d'électrons non appariés avec des spins parallèles. Cela minimise l'énergie totale de l'atome. Il existe cependant des exceptions à cette règle, en particulier pour les métaux de transition, où la stabilité des couches électroniques complètes ou à moitié remplies peut influencer la configuration électronique observée (par exemple, le chrome et le cuivre).
Exemple concret : Le Fer (Fe)
Le fer (Fe) a un numéro atomique de 26. Sa configuration électronique complète est 1s22s22p63s23p64s23d6. Sa configuration électronique condensée est [Ar]4s23d6. Le fer est un métal de transition, et ses propriétés chimiques sont influencées par la configuration électronique de ses orbitales d partiellement remplies. Il peut former des ions Fe2+ (en perdant les deux électrons 4s) et Fe3+ (en perdant également un électron 3d), ce qui lui permet de participer à de nombreuses réactions chimiques importantes, comme le transport de l'oxygène dans l'hémoglobine.
Ce qu'il faut retenir
- La configuration électronique décrit la distribution des électrons dans les orbitales atomiques.
- Le principe de remplissage de Aufbau et la règle de Hund aident à déterminer la configuration électronique d'un atome.
- La position d'un élément dans le tableau périodique est liée à sa configuration électronique de valence.
- Les éléments du même groupe ont des propriétés chimiques similaires en raison de leur configuration électronique de valence similaire.
FAQ
-
Comment puis-je déterminer la configuration électronique d'un élément en utilisant le tableau périodique ?
Vous pouvez utiliser le tableau périodique pour suivre l'ordre de remplissage des orbitales et déterminer la configuration électronique de l'élément en fonction de sa position dans le tableau. N'oubliez pas de prendre en compte le principe de Aufbau et la règle de Hund. -
Pourquoi les éléments du même groupe ont-ils des propriétés chimiques similaires ?
Les éléments du même groupe ont des propriétés chimiques similaires car ils ont la même configuration électronique de valence, c'est-à-dire le même nombre d'électrons dans leur couche externe. Ces électrons sont responsables des interactions chimiques avec d'autres atomes. -
Quelles sont les exceptions à la règle de Hund ?
Il existe des exceptions à la règle de Hund, en particulier pour les métaux de transition, où la stabilité des couches électroniques complètes ou à moitié remplies peut influencer la configuration électronique observée.
