Physique-Chimie > Mesures et Incertitudes > Instruments de Mesure > Chiffres significatifs
Calculs et arrondis avec les chiffres significatifs : Guide pratique
Apprenez à appliquer les règles des chiffres significatifs lors de vos calculs en physique-chimie. Cette ressource détaille les opérations d'addition, de soustraction, de multiplication et de division, avec des exemples concrets.
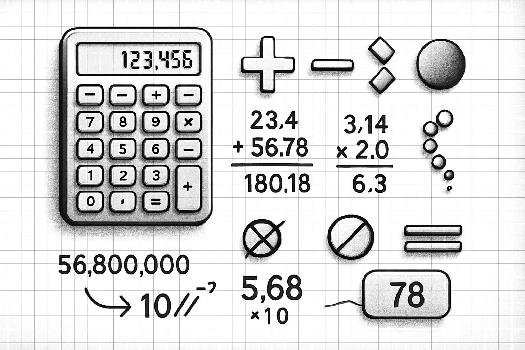
Addition et Soustraction : La règle du moins précis
Lors d'une addition ou d'une soustraction, le résultat final doit avoir le même nombre de décimales (chiffres après la virgule) que le nombre avec le moins de décimales. C'est le principe du 'moins précis' qui prévaut. Imaginons que vous additionnez deux mesures : 12,56 cm et 3,4 cm. Le premier nombre a deux décimales, et le second, une seule. Le résultat de l'addition (15,96 cm) doit être arrondi à 16,0 cm, car le nombre le moins précis (3,4 cm) n'a qu'une seule décimale.
Multiplication et Division : Le nombre de chiffres significatifs compte
Pour les multiplications et les divisions, la règle est différente. Le résultat final doit avoir le même nombre de chiffres significatifs que le nombre avec le moins de chiffres significatifs. Prenons un exemple : vous divisez une distance de 45,2 mètres par un temps de 2,5 secondes. La distance a trois chiffres significatifs, et le temps en a deux. Le résultat de la division (18,08 m/s) doit être arrondi à 18 m/s, car le temps (2,5 s) n'a que deux chiffres significatifs. Attention, il ne faut pas arrondir les résultats intermédiaires lors de calculs successifs. N'arrondissez qu'à la fin pour minimiser les erreurs.
Exemples détaillés avec des calculs
Exemple 1 : Addition
Calcul : 23,456 g + 1,2 g + 0,0034 g
- 23,456 g a cinq chiffres significatifs et trois décimales.
- 1,2 g a deux chiffres significatifs et une décimale.
- 0,0034 g a deux chiffres significatifs et quatre décimales.
Résultat brut : 24,6594 g
Arrondi : 24,7 g (car 1,2 g a une décimale).
Exemple 2 : Multiplication
Calcul : 4,56 cm x 1,4 cm
- 4,56 cm a trois chiffres significatifs.
- 1,4 cm a deux chiffres significatifs.
Résultat brut : 6,384 cm2
Arrondi : 6,4 cm2 (car 1,4 cm a deux chiffres significatifs).
Exemple 3 : Combinaison d'opérations
Calcul : (15,67 g – 2,3 g) / 4,56 mL
- Soustraction : 15,67 g – 2,3 g = 13,37 g (arrondi à 13,4 g car 2,3 g a une décimale).
- Division : 13,4 g / 4,56 mL = 2,938596... g/mL
Arrondi final : 2,94 g/mL (car 4,56 mL a trois chiffres significatifs).
L'importance de la notation scientifique
La notation scientifique est votre amie ! Elle vous permet d'exprimer clairement le nombre de chiffres significatifs, surtout quand il s'agit de grands nombres ou de nombres très petits. Par exemple, si vous avez une mesure de 3000 mètres et que vous savez que seuls les deux premiers chiffres sont significatifs, vous pouvez l'écrire 3,0 x 103 m. Cela indique clairement que seuls les chiffres 3 et 0 sont significatifs. Si les quatre chiffres étaient significatifs, vous écririez 3,000 x 103 m.
Pièges à éviter
Ce qu'il faut retenir
- Addition et Soustraction : Le résultat a le même nombre de décimales que le nombre le moins précis.
- Multiplication et Division : Le résultat a le même nombre de chiffres significatifs que le nombre avec le moins de chiffres significatifs.
- Notation scientifique : Utile pour exprimer clairement les chiffres significatifs dans les grands et petits nombres.
- Erreurs à éviter : Ne pas arrondir les résultats intermédiaires, toujours indiquer les unités, faire attention aux zéros.
FAQ
-
Pourquoi ne faut-il pas arrondir les résultats intermédiaires ?
Arrondir les résultats intermédiaires peut introduire des erreurs qui s'accumulent et affectent la précision du résultat final. -
Comment utiliser la notation scientifique pour indiquer les chiffres significatifs ?
La notation scientifique permet de contrôler le nombre de chiffres significatifs en ajustant le coefficient (le nombre avant la puissance de 10). Par exemple, 3,0 x 103 a deux chiffres significatifs.
