Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Acides et Bases > pH
Le pH : Guide Complet
Explorez en détail la notion de pH, son importance, son calcul et son impact dans la chimie des solutions aqueuses. Ce guide complet est conçu pour les élèves de lycée et offre une explication claire et accessible des concepts clés liés au pH.
Définition du pH
Le pH, ou potentiel hydrogène, est une mesure de l'acidité ou de la basicité d'une solution aqueuse. Il est défini comme le logarithme décimal négatif de l'activité des ions hydronium (H3O+). En termes simplifiés, le pH indique la concentration d'ions H3O+ dans une solution.
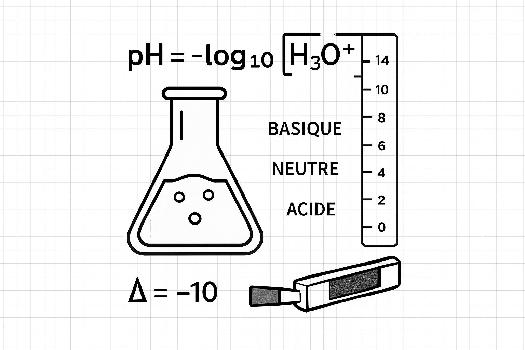
Mathématiquement, cela s'exprime par la formule : pH = -log10[H3O+]
Une solution est considérée comme :
- Acide si son pH est inférieur à 7.
- Neutre si son pH est égal à 7.
- Basique (ou alcaline) si son pH est supérieur à 7.
Il est crucial de comprendre que l'échelle de pH est logarithmique. Cela signifie qu'une différence d'une unité de pH correspond à une différence d'un facteur 10 dans la concentration d'ions H3O+. Par exemple, une solution avec un pH de 3 est 10 fois plus acide qu'une solution avec un pH de 4, et 100 fois plus acide qu'une solution avec un pH de 5.
L'échelle de pH
L'échelle de pH s'étend généralement de 0 à 14.
- pH 0-6: Indique une solution acide. Plus le pH est bas, plus l'acidité est élevée. Par exemple, le jus de citron a un pH d'environ 2, et l'acide gastrique peut avoir un pH aussi bas que 1.
- pH 7: Indique une solution neutre. L'eau pure (à 25°C) est un exemple de solution neutre.
- pH 8-14: Indique une solution basique (ou alcaline). Plus le pH est élevé, plus la basicité est élevée. Par exemple, l'ammoniaque domestique a un pH d'environ 11, et la soude caustique (hydroxyde de sodium) a un pH de 14.
Il est important de noter que certaines solutions peuvent avoir un pH en dehors de la gamme 0-14 dans des conditions extrêmes, mais cela est moins courant dans les applications quotidiennes. Il existe des indicateurs colorés pour évaluer le pH, tel que le papier pH.
Calcul du pH
Le calcul du pH dépend de la connaissance de la concentration en ions hydronium (H3O+) dans la solution. Voici les étapes à suivre :
- Identifier la concentration en ions H3O+ : Si la concentration est directement donnée, vous pouvez passer à l'étape suivante. Sinon, elle peut être déduite de la concentration d'un acide fort (qui se dissocie complètement en solution) ou d'une base forte (qui produit des ions hydroxyde OH-, permettant de calculer ensuite la concentration en H3O+ grâce au produit ionique de l'eau, Kw).
- Appliquer la formule : pH = -log10[H3O+]. Utilisez une calculatrice scientifique pour calculer le logarithme décimal.
- Interpréter le résultat : Le nombre obtenu est le pH de la solution. Comparez-le à l'échelle de pH (0-14) pour déterminer si la solution est acide, neutre ou basique.
Exemple :
Si la concentration en ions H3O+ dans une solution est de 1.0 x 10-3 mol/L, alors :
pH = -log10(1.0 x 10-3) = -(-3) = 3
La solution est donc acide.
Le pOH
Le pOH est une mesure de la concentration en ions hydroxyde (OH-) dans une solution aqueuse. Il est défini comme le logarithme décimal négatif de la concentration en ions hydroxyde :
pOH = -log10[OH-]
Le pH et le pOH sont liés par la relation : pH + pOH = 14 (à 25°C). Cette relation est dérivée du produit ionique de l'eau, Kw = [H3O+][OH-] = 1.0 x 10-14 à 25°C. En prenant le logarithme négatif des deux côtés, on obtient la relation entre pH et pOH.
Connaître le pOH peut être utile pour calculer le pH d'une solution basique. Par exemple, si vous connaissez la concentration en ions OH-, vous pouvez calculer le pOH, puis utiliser la relation pH + pOH = 14 pour trouver le pH.
Indicateurs de pH
Les indicateurs de pH sont des substances qui changent de couleur en fonction du pH de la solution. Ils sont souvent utilisés pour estimer le pH d'une solution de manière simple et rapide.
Types d'indicateurs :
- Indicateurs colorés : Ce sont des substances organiques qui présentent une couleur différente selon le pH. Des exemples courants incluent le bleu de bromothymol, le rouge de méthyle, et la phénolphtaléine.
- Papier pH : Il s'agit de papier imprégné d'un mélange d'indicateurs colorés. Le papier pH change de couleur lorsqu'il est trempé dans une solution, et la couleur obtenue peut être comparée à une échelle de couleurs pour estimer le pH.
- pH-mètres : Ce sont des instruments électroniques qui mesurent le pH avec une grande précision. Ils utilisent une électrode sensible aux ions H3O+ pour déterminer le pH.
Chaque indicateur a une zone de virage de pH spécifique, c'est-à-dire une plage de pH dans laquelle il change de couleur. Le choix de l'indicateur dépend donc de la gamme de pH que l'on souhaite mesurer.
Ce qu'il faut retenir
- Le pH mesure l'acidité ou la basicité d'une solution aqueuse. pH = -log10[H3O+].
- L'échelle de pH s'étend de 0 à 14 : 0-6 (acide), 7 (neutre), 8-14 (basique).
- Une différence d'une unité de pH correspond à une différence d'un facteur 10 dans la concentration en ions H3O+.
- Le pOH mesure la concentration en ions OH-. pH + pOH = 14 (à 25°C).
- Les indicateurs de pH (colorés, papier pH, pH-mètres) permettent de déterminer le pH d'une solution.
FAQ
-
Quelle est la différence entre un acide fort et un acide faible ?
Un acide fort se dissocie complètement en ions H3O+ et son anion dans l'eau, tandis qu'un acide faible ne se dissocie que partiellement. Cela signifie qu'à la même concentration, un acide fort abaissera le pH plus qu'un acide faible. -
Pourquoi est-il important de mesurer le pH ?
Le pH joue un rôle crucial dans de nombreux domaines, notamment la biologie, la chimie, l'agriculture et l'environnement. Il influence les réactions chimiques, la solubilité des substances, et l'activité des enzymes. Par exemple, le pH du sol affecte la disponibilité des nutriments pour les plantes, et le pH du sang doit être maintenu dans une plage étroite pour assurer le bon fonctionnement des organes.
