Physique-Chimie > Physique Quantique (Notions Terminale) > Niveaux d'Énergie Atomique > Spectres d'émission et d'absorption (notions)
Niveaux d'énergie atomique et spectres d'émission/absorption
Comprendre les niveaux d'énergie atomique et leur lien avec les spectres d'émission et d'absorption. Ce cours aborde les notions essentielles pour les élèves de terminale en physique-chimie.
Les niveaux d'énergie atomique : une introduction
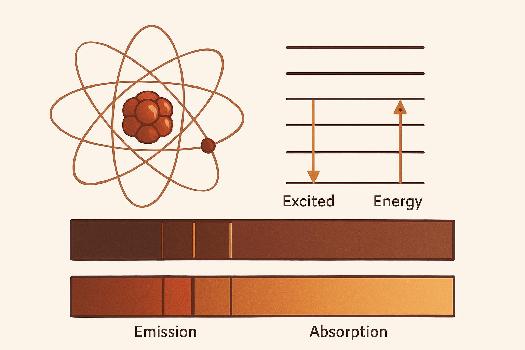
L'énergie d'un atome n'est pas continue, mais quantifiée. Cela signifie que l'atome ne peut exister que dans certains états d'énergie bien définis, appelés niveaux d'énergie. Imaginez une échelle où l'atome ne peut se trouver que sur des marches spécifiques, et non entre deux marches.
Chaque niveau d'énergie est caractérisé par un nombre quantique. Le niveau d'énergie le plus bas est appelé état fondamental. Les niveaux d'énergie supérieurs sont appelés états excités. Pour passer d'un niveau d'énergie inférieur à un niveau supérieur, l'atome doit absorber de l'énergie. Pour passer d'un niveau d'énergie supérieur à un niveau inférieur, l'atome doit émettre de l'énergie.
Le modèle de Bohr revisité
Le modèle de Bohr, bien que simplifié, est utile pour comprendre qualitativement les niveaux d'énergie. Il imagine les électrons orbitant autour du noyau sur des trajectoires circulaires précises. Chaque trajectoire correspond à un niveau d'énergie. Plus l'électron est éloigné du noyau, plus son niveau d'énergie est élevé.
Bien sûr, le modèle de Bohr a ses limites et est aujourd'hui remplacé par des modèles plus sophistiqués basés sur la mécanique quantique. Mais il reste un outil pédagogique pertinent pour visualiser la quantification de l'énergie.
Transitions atomiques et photons
Lorsqu'un atome passe d'un niveau d'énergie supérieur (Esup) à un niveau d'énergie inférieur (Einf), il émet un photon. L'énergie du photon est égale à la différence d'énergie entre les deux niveaux :
Ephoton = Esup - Einf
Cette énergie est également liée à la fréquence (ν) et à la longueur d'onde (λ) du photon par les équations :
Ephoton = hν et λ = c/ν
où h est la constante de Planck (environ 6,626 x 10-34 J.s) et c est la vitesse de la lumière (environ 3 x 108 m/s). Inversement, pour qu'un atome passe d'un niveau d'énergie inférieur à un niveau supérieur, il doit absorber un photon d'énergie précisément égale à la différence d'énergie entre les deux niveaux.
Spectres d'émission
Un spectre d'émission est le spectre des longueurs d'onde émises par une substance. Lorsque des atomes sont excités (par exemple, par la chaleur ou une décharge électrique), ils émettent des photons à des longueurs d'onde spécifiques, correspondant aux transitions entre leurs niveaux d'énergie. Ces photons émis apparaissent comme des raies spectrales lumineuses sur un fond sombre. Chaque élément chimique possède un spectre d'émission unique, qui peut être utilisé pour l'identifier. On parle d'empreinte spectrale.
Par exemple, le spectre d'émission de l'hydrogène présente des raies spectrales bien définies dans le visible, l'ultraviolet et l'infrarouge. L'étude de ces raies a permis de valider le modèle de Bohr et de mieux comprendre la structure atomique.
Spectres d'absorption
Un spectre d'absorption est le spectre des longueurs d'onde absorbées par une substance. Lorsqu'une lumière blanche traverse un gaz, les atomes du gaz absorbent les photons dont l'énergie correspond aux transitions entre leurs niveaux d'énergie. Les longueurs d'onde absorbées apparaissent comme des raies spectrales sombres sur un fond continu de lumière. Les raies d'absorption d'un élément coïncident avec les raies d'émission de cet élément.
L'étude des spectres d'absorption permet de déterminer la composition des atmosphères stellaires. Par exemple, en analysant le spectre de la lumière provenant d'une étoile, on peut identifier les éléments chimiques présents dans son atmosphère.
Exemple concret : Lampe spectrale à vapeur de mercure
Une lampe spectrale à vapeur de mercure contient de la vapeur de mercure sous basse pression. Lorsqu'une décharge électrique traverse la vapeur de mercure, les atomes de mercure sont excités. Ces atomes excités retournent ensuite à leur état fondamental en émettant des photons à des longueurs d'onde spécifiques, produisant un spectre d'émission caractéristique du mercure. Ce spectre est utilisé pour calibrer des spectromètres ou pour étudier les propriétés de la lumière.
Ce qu'il faut retenir
- L'énergie d'un atome est quantifiée : elle ne peut prendre que des valeurs discrètes (niveaux d'énergie).
- L'état fondamental est le niveau d'énergie le plus bas. Les autres niveaux sont les états excités.
- Une transition atomique correspond au passage d'un électron d'un niveau d'énergie à un autre.
- Lorsqu'un atome passe d'un niveau supérieur à un niveau inférieur, il émet un photon dont l'énergie est égale à la différence d'énergie entre les deux niveaux.
- Lorsqu'un atome passe d'un niveau inférieur à un niveau supérieur, il absorbe un photon de la même énergie.
- Un spectre d'émission est l'ensemble des longueurs d'onde émises par une substance. Il est constitué de raies lumineuses sur fond sombre.
- Un spectre d'absorption est l'ensemble des longueurs d'onde absorbées par une substance. Il est constitué de raies sombres sur fond continu.
- Chaque élément chimique possède un spectre d'émission et d'absorption unique, qui constitue son empreinte spectrale.
FAQ
-
Qu'est-ce qui différencie un spectre d'émission d'un spectre d'absorption ?
Un spectre d'émission montre les longueurs d'onde de la lumière émise par une substance, apparaissant comme des raies brillantes sur un fond sombre. Un spectre d'absorption, au contraire, montre les longueurs d'onde de la lumière absorbée par une substance, apparaissant comme des raies sombres sur un fond lumineux et continu. -
Pourquoi chaque élément a-t-il un spectre unique ?
Chaque élément a une structure électronique unique, ce qui signifie que ses niveaux d'énergie sont différents de ceux des autres éléments. Les transitions entre ces niveaux d'énergie produisent des photons de longueurs d'onde spécifiques, créant ainsi un spectre unique. -
Comment utilise-t-on les spectres en astrophysique ?
Les spectres d'absorption et d'émission sont utilisés pour déterminer la composition des étoiles et des galaxies. En analysant la lumière qu'elles émettent ou absorbent, les astrophysiciens peuvent identifier les éléments présents et mesurer leur abondance.
