Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Atomes (noyau, électrons, protons, neutrons)
Structure de l'Atome : Noyau et Cortège Électronique
Découvrez la composition de l'atome : noyau (protons et neutrons) et cortège électronique. Explorez les propriétés et l'organisation de ces particules fondamentales.
Introduction à l'Atome
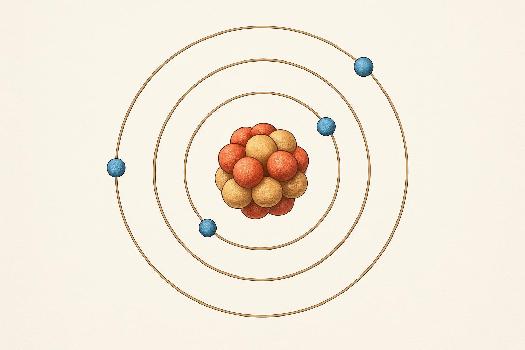
L'atome est l'unité de base de la matière. Tout ce qui nous entoure est constitué d'atomes. Bien qu'ils soient extrêmement petits, les atomes possèdent une structure complexe qui détermine leurs propriétés chimiques. On distingue deux parties principales dans un atome : le noyau et le cortège électronique.
Le Noyau Atomique
Le noyau est la partie centrale de l'atome et contient la quasi-totalité de sa masse. Il est composé de deux types de particules :
- Protons : Les protons sont des particules chargées positivement. Le nombre de protons dans le noyau détermine l'élément chimique. Par exemple, tous les atomes avec un proton sont des atomes d'hydrogène. Ce nombre est appelé numéro atomique (Z).
- Neutrons : Les neutrons sont des particules neutres (sans charge). Ils contribuent à la masse du noyau et à sa stabilité. Le nombre de neutrons peut varier pour un même élément, donnant naissance à des isotopes.
Le Cortège Électronique
Le cortège électronique est constitué d'électrons, des particules chargées négativement, qui gravitent autour du noyau. Les électrons sont beaucoup plus légers que les protons et les neutrons. Le nombre d'électrons dans un atome neutre est égal au nombre de protons dans le noyau (Z).
Les électrons ne se déplacent pas n'importe comment autour du noyau. Ils occupent des couches électroniques ou niveaux d'énergie spécifiques. Chaque couche peut contenir un nombre maximal d'électrons. La couche la plus proche du noyau (n=1) peut contenir au maximum 2 électrons, la couche suivante (n=2) peut en contenir 8, et ainsi de suite.
La couche électronique la plus externe, appelée couche de valence, est particulièrement importante car elle détermine la réactivité chimique de l'atome. Les atomes tendent à acquérir une configuration électronique stable, souvent en ayant une couche de valence complètement remplie (comme les gaz nobles).
Isotopes
Les isotopes sont des atomes d'un même élément (même nombre de protons) qui ont un nombre différent de neutrons. Par exemple, le carbone-12 (12C) et le carbone-14 (14C) sont des isotopes du carbone. Ils ont tous les deux 6 protons, mais le carbone-12 a 6 neutrons tandis que le carbone-14 en a 8. Les isotopes ont des propriétés chimiques similaires mais peuvent avoir des propriétés physiques différentes, notamment en termes de stabilité nucléaire et de radioactivité.
Ce qu'il faut retenir
- L'atome est l'unité de base de la matière.
- Il est composé d'un noyau (protons et neutrons) et d'un cortège électronique (électrons).
- Les protons sont chargés positivement et leur nombre (Z) détermine l'élément chimique.
- Les neutrons sont neutres et contribuent à la masse du noyau.
- Les électrons sont chargés négativement et gravitent autour du noyau sur des couches électroniques.
- Le nombre d'électrons dans un atome neutre est égal au nombre de protons (Z).
- Le nombre de masse (A) est la somme du nombre de protons et de neutrons.
- Les isotopes sont des atomes du même élément avec un nombre différent de neutrons.
FAQ
-
Quelle est la charge électrique d'un atome neutre ?
Un atome neutre a une charge électrique globale de zéro, car le nombre de protons (charges positives) est égal au nombre d'électrons (charges négatives). -
Qu'est-ce qui distingue un élément chimique d'un autre ?
Le nombre de protons (numéro atomique Z) dans le noyau distingue un élément chimique d'un autre. Chaque élément a un nombre spécifique de protons. -
Où se trouvent les électrons dans l'atome?
Les électrons se trouvent dans le cortège électronique, répartis sur des couches ou niveaux d'énergie autour du noyau. La couche la plus interne est appelée couche K, suivie des couches L, M, etc.
