Physique-Chimie > Chimie - La Matière et ses Transformations > Transformations Physiques > Température et pression
La Température et la Pression : Acteurs Clés des Transformations Physiques
Explorez comment la température et la pression influencent les changements d'état de la matière, du solide au gaz, et comprenez les principes fondamentaux qui régissent ces transformations.
Introduction : États de la Matière et Transitions
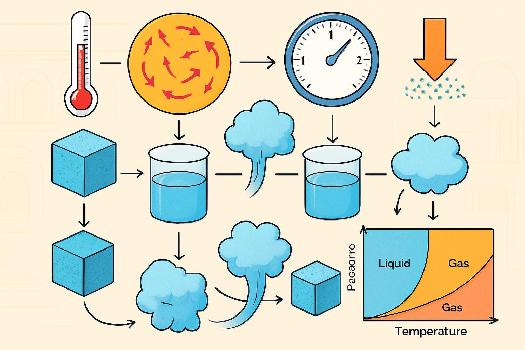
Les trois états fondamentaux de la matière sont solide, liquide et gaz. Une transformation physique est un changement d'état qui ne modifie pas la composition chimique de la substance. Comprendre l'influence de la température et de la pression sur ces transformations est crucial en chimie. Par exemple, l'eau peut exister sous forme de glace (solide), d'eau liquide ou de vapeur (gaz), en fonction de la température et de la pression.
La Température et l'Agitation Thermique
La température est une mesure de l'agitation thermique des particules (atomes, molécules) dans une substance. Plus la température est élevée, plus les particules bougent rapidement. Cette agitation thermique influence directement les forces intermoléculaires, qui maintiennent les particules ensemble.
- Solide : Les particules sont étroitement liées, avec une faible agitation thermique.
- Liquide : Les particules ont plus de liberté de mouvement, mais restent liées.
- Gaz : Les particules sont presque complètement libres et se déplacent de manière aléatoire.
Fusion et Solidification : Le Rôle de la Température
- Fusion : Le passage d'un solide à un liquide se produit lorsque la température atteint le point de fusion. À cette température, l'agitation thermique est suffisante pour briser les liaisons qui maintiennent la structure solide. Par exemple, la glace fond à 0°C sous pression atmosphérique normale.
- Solidification : Le passage d'un liquide à un solide se produit lorsque la température diminue jusqu'au point de congélation (qui est généralement le même que le point de fusion). Les forces intermoléculaires reprennent le dessus et les particules se réorganisent en une structure solide.
Vaporisation et Condensation : Le Changement Liquide-Gaz
- Vaporisation : Le passage d'un liquide à un gaz peut se faire par ébullition ou par évaporation. L'ébullition se produit lorsque la température atteint le point d'ébullition. L'évaporation se produit à n'importe quelle température, mais est plus rapide à des températures plus élevées. L'eau bout à 100°C sous pression atmosphérique normale.
- Condensation : Le passage d'un gaz à un liquide se produit lorsque la température diminue jusqu'au point de rosée. Les particules de gaz perdent de l'énergie cinétique et les forces intermoléculaires les attirent, formant un liquide.
Sublimation et Condensation Sèche
- Sublimation : Le passage direct d'un solide à un gaz se produit lorsque la pression est faible et la température suffisamment élevée. Un exemple courant est la sublimation de la glace sèche (dioxyde de carbone solide) à température ambiante.
- Condensation Sèche (Déposition) : Le passage direct d'un gaz à un solide se produit lorsque la température est basse et la pression appropriée. Un exemple est la formation de givre.
La Pression et son Influence
La pression est la force exercée par une substance sur une surface. Dans les gaz, la pression est due aux collisions des particules avec les parois du récipient. La pression a un effet significatif sur les points de fusion et d'ébullition.
- Augmentation de la pression : Augmente généralement les points de fusion et d'ébullition. Par exemple, dans une cocotte-minute, la pression est augmentée, ce qui permet à l'eau de bouillir à une température supérieure à 100°C, accélérant la cuisson.
- Diminution de la pression : Diminue les points de fusion et d'ébullition. Au sommet d'une montagne, la pression atmosphérique est plus faible, donc l'eau bout à une température inférieure à 100°C.
Diagrammes de Phase
Un diagramme de phase représente les états physiques d'une substance en fonction de la température et de la pression. Il permet de visualiser les domaines de stabilité de chaque phase (solide, liquide, gaz) et les points où coexistent plusieurs phases (point triple, point critique). Comprendre et interpréter ces diagrammes est essentiel pour prédire le comportement d'une substance dans différentes conditions.
Exemples Concrets et Applications
- La congélation des aliments : La baisse de température permet de ralentir l'activité biologique et chimique, conservant les aliments plus longtemps.
- La distillation : La différence de points d'ébullition permet de séparer des liquides miscibles.
- La fabrication de la glace sèche : Le dioxyde de carbone gazeux est comprimé et refroidi pour former de la glace sèche solide.
- La lyophilisation : Technique de déshydratation qui utilise la sublimation pour conserver des produits sensibles à la chaleur.
Ce qu'il faut retenir
- La température est une mesure de l'agitation thermique des particules.
- La pression est la force exercée par une substance sur une surface.
- Les transformations physiques sont des changements d'état qui ne modifient pas la composition chimique.
- La fusion est le passage d'un solide à un liquide.
- La solidification est le passage d'un liquide à un solide.
- La vaporisation est le passage d'un liquide à un gaz (ébullition ou évaporation).
- La condensation est le passage d'un gaz à un liquide.
- La sublimation est le passage direct d'un solide à un gaz.
- La condensation sèche est le passage direct d'un gaz à un solide.
- L'augmentation de la pression augmente généralement les points de fusion et d'ébullition.
- Un diagramme de phase représente les états physiques d'une substance en fonction de la température et de la pression.
FAQ
-
Qu'est-ce qu'une transformation physique ?
Une transformation physique est un changement d'état de la matière qui ne modifie pas sa composition chimique. Par exemple, la fusion de la glace en eau liquide est une transformation physique. -
Comment la température affecte-t-elle l'état de la matière ?
La température influence l'agitation thermique des particules. Une augmentation de température favorise les états plus désordonnés (liquide, gaz), tandis qu'une diminution favorise les états plus ordonnés (solide). -
Comment la pression affecte-t-elle l'état de la matière ?
En général, une augmentation de pression favorise les états plus denses (solide, liquide) et augmente les points de fusion et d'ébullition. -
Qu'est-ce qu'un diagramme de phase ?
Un diagramme de phase est une représentation graphique des états physiques d'une substance en fonction de la température et de la pression. Il permet de déterminer l'état de la substance dans des conditions spécifiques.
