Physique-Chimie > Chimie - La Matière et ses Transformations > Réactions Chimiques > Concentration des solutions (molaire, massique)
Concentrations Molaires et Massiques: Comprendre et Calculer
Un guide complet pour comprendre et calculer les concentrations molaires et massiques des solutions, avec des exemples et exercices pour les élèves de lycée.
Introduction à la Concentration
La concentration d'une solution est une mesure de la quantité de soluté dissous dans un solvant. Il est crucial de comprendre que soluté est la substance qui se dissout, et le solvant est la substance dans laquelle elle se dissout. L'eau est un solvant très courant, mais il en existe d'autres. Différentes manières existent pour exprimer la concentration, notamment la concentration molaire et la concentration massique, qui sont les plus couramment utilisées en chimie au lycée.
Concentration Molaire
La concentration molaire, souvent notée C (ou [ ]), représente le nombre de moles de soluté par litre de solution. Son unité est la mole par litre (mol/L) ou M (molaire).
La formule de la concentration molaire est la suivante :
C = n / V
Où :
- C est la concentration molaire (mol/L)
- n est la quantité de matière de soluté (en moles)
- V est le volume de la solution (en litres)
Exemple: Si on dissout 0,5 mole de NaCl (chlorure de sodium) dans 2 litres d'eau, la concentration molaire de la solution est C = 0,5 mol / 2 L = 0,25 mol/L.
Concentration Massique
La concentration massique, souvent notée Cm, représente la masse de soluté par litre de solution. Son unité est le gramme par litre (g/L).
La formule de la concentration massique est la suivante :
Cm = m / V
Où :
- Cm est la concentration massique (g/L)
- m est la masse de soluté (en grammes)
- V est le volume de la solution (en litres)
Exemple: Si on dissout 10 grammes de sucre dans 0,5 litre d'eau, la concentration massique de la solution est Cm = 10 g / 0,5 L = 20 g/L.
Relation entre Concentration Molaire et Massique
Il existe une relation directe entre la concentration molaire et la concentration massique, qui est liée à la masse molaire du soluté (M).
La masse molaire (M) d'une substance est la masse d'une mole de cette substance (en g/mol). Elle peut être calculée à partir des masses atomiques des éléments qui composent la substance, que l'on trouve dans le tableau périodique.
La relation est la suivante:
Cm = C * M
Ou:
C = Cm / M
Où :
- Cm est la concentration massique (g/L)
- C est la concentration molaire (mol/L)
- M est la masse molaire du soluté (g/mol)
Exemple: Reprenons l'exemple du NaCl. Sa masse molaire (M) est d'environ 58,5 g/mol. Si une solution de NaCl a une concentration molaire de 0,25 mol/L, sa concentration massique est Cm = 0,25 mol/L * 58,5 g/mol = 14,625 g/L.
Préparation de Solutions
Pour préparer une solution de concentration donnée, il faut calculer la masse de soluté nécessaire. On utilise les formules des concentrations et la relation entre elles.
Exemple de préparation d'une solution de concentration molaire donnée:
Comment préparer 250 mL d'une solution de NaCl à 0,1 mol/L ?
1. Calculer le nombre de moles de NaCl nécessaire :
n = C * V = 0,1 mol/L * 0,250 L = 0,025 mol
2. Calculer la masse de NaCl correspondante :
m = n * M = 0,025 mol * 58,5 g/mol = 1,4625 g
3. Peser 1,4625 g de NaCl et le dissoudre dans suffisamment d'eau pour obtenir un volume final de 250 mL.
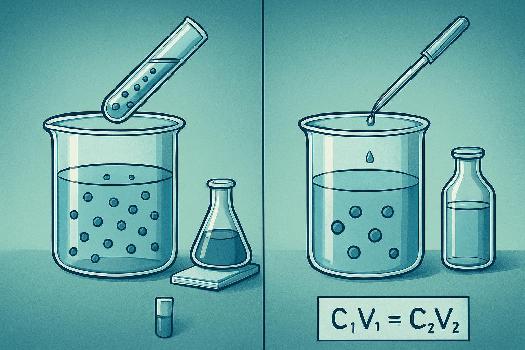
Dilution
La dilution consiste à diminuer la concentration d'une solution en ajoutant du solvant. La quantité de soluté ne change pas lors de la dilution. On utilise la formule suivante:
C1V1 = C2V2
Où:
- C1 est la concentration initiale
- V1 est le volume initial
- C2 est la concentration finale
- V2 est le volume final
Exemple: On a une solution de NaCl à 1 mol/L. On veut préparer 100 mL d'une solution à 0,1 mol/L. Quel volume de la solution initiale faut-il prélever ?
V1 = (C2V2) / C1 = (0,1 mol/L * 100 mL) / 1 mol/L = 10 mL
Il faut donc prélever 10 mL de la solution initiale et ajouter du solvant jusqu'à un volume final de 100 mL.
Ce qu'il faut retenir
- La concentration molaire (C) est le nombre de moles de soluté par litre de solution : C = n / V (mol/L).
- La concentration massique (Cm) est la masse de soluté par litre de solution : Cm = m / V (g/L).
- La masse molaire (M) relie les concentrations molaire et massique : Cm = C * M.
- Pour préparer une solution de concentration donnée, on calcule la masse de soluté nécessaire.
- La dilution est une opération qui consiste à diminuer la concentration d'une solution : C1V1 = C2V2.
FAQ
-
Quelle est la différence entre concentration molaire et concentration massique ?
La concentration molaire exprime la quantité de matière (en moles) de soluté par litre de solution, tandis que la concentration massique exprime la masse (en grammes) de soluté par litre de solution. Elles sont liées par la masse molaire du soluté. -
Comment calculer la masse molaire d'une substance ?
La masse molaire d'une substance est la somme des masses atomiques des éléments qui la composent, multipliées par leur nombre d'atomes dans la formule chimique de la substance. On trouve les masses atomiques dans le tableau périodique. -
Pourquoi est-il important de bien maîtriser les concentrations en chimie ?
La compréhension des concentrations est essentielle pour préparer des solutions avec précision, effectuer des calculs stœchiométriques, et comprendre les réactions chimiques en solution. C'est une base fondamentale pour de nombreuses applications en chimie.
