Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Forces intermoléculaires (Van der Waals, liaisons hydrogène - notions)
Forces Intermoléculaires : Comprendre les Interactions Moléculaires
Explorez les forces intermoléculaires, notamment les forces de Van der Waals et les liaisons hydrogène, essentielles pour comprendre les propriétés physiques de la matière. Découvrez comment ces interactions influencent les états de la matière et les phénomènes chimiques.
Introduction aux Forces Intermoléculaires
Les forces intermoléculaires sont des attractions ou des répulsions entre les molécules. Elles sont responsables de nombreuses propriétés macroscopiques de la matière, comme les points d'ébullition, les points de fusion, la viscosité et la tension superficielle. Ces forces sont généralement beaucoup plus faibles que les liaisons intramoléculaires (covalentes, ioniques, métalliques) qui maintiennent les atomes ensemble au sein d'une molécule. Il existe différents types de forces intermoléculaires, les plus courantes étant les forces de Van der Waals (forces de dispersion de London, forces de Keesom, forces de Debye) et les liaisons hydrogène.
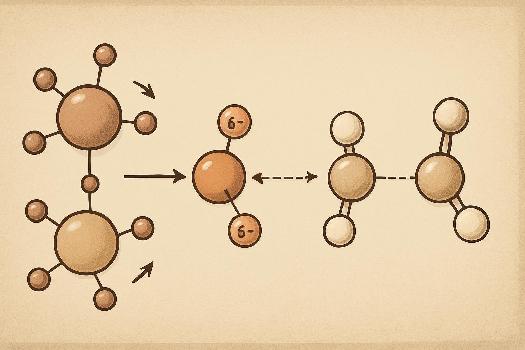
Forces de Van der Waals
Les forces de Van der Waals sont des forces d'attraction faibles qui existent entre toutes les molécules. Elles sont dues à des fluctuations temporaires de la distribution des électrons dans les molécules. Ces fluctuations créent des dipôles instantanés qui induisent des dipôles dans les molécules voisines, entraînant une attraction.
- Forces de dispersion de London (forces de London) : Présentes dans toutes les molécules, polaires ou apolaires. Elles sont dues à la formation de dipôles instantanés et induits. L'intensité de ces forces augmente avec la taille et la polarisabilité de la molécule (capacité de la distribution électronique à se déformer).
- Forces de Keesom (forces dipôle-dipôle) : Existent entre les molécules polaires, possédant un dipôle permanent. L'extrémité positive d'une molécule est attirée par l'extrémité négative d'une autre.
- Forces de Debye (forces dipôle-induit) : Se produisent entre une molécule polaire et une molécule apolaire. La molécule polaire induit un dipôle dans la molécule apolaire.
Liaisons Hydrogène
Les liaisons hydrogène sont un type particulier d'interaction dipôle-dipôle qui se produit lorsqu'un atome d'hydrogène est lié à un atome très électronégatif comme l'oxygène (O), l'azote (N) ou le fluor (F). L'atome d'hydrogène porte alors une charge partielle positive importante et peut interagir avec un atome portant une charge partielle négative d'une autre molécule, ou même d'une autre partie de la même molécule. Les liaisons hydrogène sont relativement fortes par rapport aux autres forces intermoléculaires, mais plus faibles que les liaisons covalentes. Elles sont responsables de nombreuses propriétés importantes de l'eau, comme son point d'ébullition élevé et sa capacité à dissoudre de nombreuses substances. Elles sont également essentielles à la structure et à la fonction des protéines et de l'ADN. Exemples :
- Entre les molécules d'eau (H2O) : l'oxygène d'une molécule attire l'hydrogène d'une autre.
- Dans l'ADN : les liaisons hydrogène stabilisent la double hélice en reliant les bases azotées complémentaires.
Influence des Forces Intermoléculaires sur les Propriétés Physiques
Les forces intermoléculaires influencent de manière significative les propriétés physiques des substances :
- Point d'ébullition et point de fusion : Plus les forces intermoléculaires sont fortes, plus il faut d'énergie pour les rompre et donc plus le point d'ébullition et le point de fusion sont élevés.
- Viscosité : La viscosité est une mesure de la résistance d'un fluide à l'écoulement. Les fluides avec des forces intermoléculaires plus fortes ont une viscosité plus élevée.
- Tension superficielle : La tension superficielle est une mesure de la force qui maintient la surface d'un liquide ensemble. Les liquides avec des forces intermoléculaires plus fortes ont une tension superficielle plus élevée.
- Solubilité : Les substances similaires ont tendance à se dissoudre les unes dans les autres. Les substances polaires se dissolvent dans les solvants polaires, et les substances apolaires se dissolvent dans les solvants apolaires. Ceci est dû aux interactions intermoléculaires entre le soluté et le solvant.
Ce qu'il faut retenir
- Les forces intermoléculaires sont des attractions ou des répulsions entre les molécules, plus faibles que les liaisons intramoléculaires.
- Les forces de Van der Waals incluent les forces de London (toujours présentes), les forces dipôle-dipôle (Keesom) et les forces dipôle-induit (Debye).
- L'intensité des forces de London augmente avec la taille et la polarisabilité des molécules.
- Les liaisons hydrogène sont des interactions dipôle-dipôle spécifiques et relativement fortes entre un atome d'hydrogène lié à O, N ou F et un autre atome électronégatif.
- Les forces intermoléculaires affectent le point d'ébullition, le point de fusion, la viscosité, la tension superficielle et la solubilité des substances.
FAQ
-
Quelle est la différence entre une liaison covalente et une force intermoléculaire ?
Une liaison covalente est une liaison forte qui se forme entre deux atomes en partageant des électrons. Elle maintient les atomes ensemble au sein d'une molécule. Une force intermoléculaire est une attraction plus faible entre des molécules, qui n'implique pas le partage d'électrons. Elle influence les propriétés physiques de la matière. -
Les forces de Van der Waals existent-elles dans toutes les molécules ?
Oui, les forces de dispersion de London (un type de force de Van der Waals) existent dans toutes les molécules, qu'elles soient polaires ou apolaires. Les forces dipôle-dipôle et dipôle-induit existent uniquement dans les molécules polaires. -
Pourquoi la liaison hydrogène est-elle si importante pour l'eau ?
Les liaisons hydrogène entre les molécules d'eau sont responsables de nombreuses propriétés uniques de l'eau, comme son point d'ébullition élevé, sa tension superficielle élevée et sa capacité à agir comme un solvant pour de nombreuses substances. Elles jouent également un rôle crucial dans les systèmes biologiques.
