Physique-Chimie > Chimie - La Matière et ses Transformations > Structure de la Matière > Représentation de Lewis
La Représentation de Lewis : Comprendre et Dessiner les Molécules
Découvrez la représentation de Lewis, un outil essentiel pour visualiser et comprendre la structure des molécules. Ce guide complet vous explique les règles de base, les exceptions et les applications pratiques de cette méthode, avec des exemples détaillés et des exercices pour consolider vos connaissances.
Introduction à la Représentation de Lewis
La représentation de Lewis, aussi appelée diagramme de Lewis, est une façon de représenter les molécules en montrant les liaisons chimiques entre les atomes ainsi que les paires d'électrons non liantes (aussi appelées doublets non liants). C'est un outil fondamental en chimie pour comprendre la structure des molécules, leurs propriétés et leur réactivité.
Elle repose sur l'idée que les atomes tendent à s'entourer de 8 électrons (règle de l'octet) ou de 2 électrons pour l'hydrogène (règle du duet) pour atteindre une configuration électronique stable, similaire à celle des gaz nobles.
Les Règles de Base de la Représentation de Lewis
Pour dessiner un diagramme de Lewis correct, suivez ces étapes:
- Déterminer le nombre total d'électrons de valence : Additionnez les électrons de valence de chaque atome dans la molécule. N'oubliez pas d'ajuster pour la charge si c'est un ion.
- Identifier l'atome central : L'atome central est généralement l'atome le moins électronégatif (sauf l'hydrogène qui est toujours en périphérie). Souvent, il s'agit de l'atome présent en plus petite quantité.
- Dessiner le squelette de la molécule : Reliez l'atome central aux autres atomes par des liaisons simples (un trait représente une paire d'électrons).
- Distribuer les électrons restants : Complétez l'octet (ou le duet pour l'hydrogène) des atomes périphériques en ajoutant des paires d'électrons non liantes.
- Vérifier l'octet de l'atome central : Si l'atome central n'a pas encore son octet complet, formez des liaisons multiples (doubles ou triples) en déplaçant des paires d'électrons non liantes des atomes périphériques vers l'atome central.
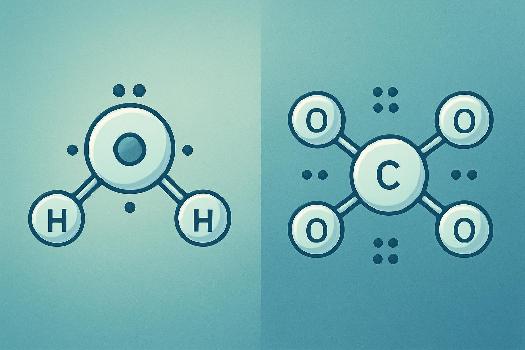
Exemple 1 : Dioxyde de Carbone (CO2)
Appliquons les règles pour le CO2 :
- Nombre d'électrons de valence : Carbone (4) + 2 x Oxygène (6) = 4 + 12 = 16 électrons.
- Atome central : Le carbone est l'atome central (moins électronégatif).
- Squelette : O - C - O
- Distribution des électrons : Chaque oxygène a besoin de 6 électrons supplémentaires pour compléter son octet. Cependant, il n'y a pas assez d'électrons pour satisfaire tout le monde avec seulement des liaisons simples.
- Formation de liaisons multiples : Chaque oxygène partage 2 paires d'électrons avec le carbone, formant une double liaison. O=C=O. Maintenant, le carbone a 8 électrons autour de lui (4 liaisons) et chaque oxygène aussi (2 liaisons + 2 paires non liantes).
Exemple 2 : Ammoniac (NH3)
Pour l'ammoniac NH3 :
- Nombre d'électrons de valence : Azote (5) + 3 x Hydrogène (1) = 5 + 3 = 8 électrons.
- Atome central : L'azote est l'atome central.
- Squelette : H - N - H (avec un H en dessous de N)
- Distribution des électrons : Chaque hydrogène a une liaison simple avec l'azote (règle du duet respectée). Il reste 2 électrons à placer sur l'azote sous forme de paire non liante.
- Vérification de l'octet : L'azote a 3 liaisons avec les hydrogènes (3 x 2 = 6 électrons) + une paire non liante (2 électrons) = 8 électrons. L'octet est complet. La représentation de Lewis est N avec 3 liaisons simple vers H et une paire non liante au dessus de N.
Exceptions à la Règle de l'Octet
Certaines molécules ne suivent pas la règle de l'octet. Les exceptions les plus courantes incluent :
- Les molécules avec un nombre impair d'électrons : Par exemple, le monoxyde d'azote (NO) a 11 électrons de valence et il est impossible de satisfaire la règle de l'octet pour les deux atomes.
- Les molécules avec un atome central déficient en électrons : Par exemple, le trifluorure de bore (BF3) où le bore n'a que 6 électrons autour de lui.
- Les molécules avec un atome central hypervalent : Par exemple, le pentafluorure de phosphore (PF5) où le phosphore a 10 électrons autour de lui.
Il est important de noter que ces exceptions sont courantes, surtout pour les éléments des périodes supérieures du tableau périodique qui peuvent accueillir plus de 8 électrons dans leur couche de valence.
Charges Formelles
La charge formelle est un outil qui permet de déterminer la distribution la plus probable des électrons dans une molécule. Elle est calculée pour chaque atome dans la molécule :
Charge Formelle = (Nombre d'électrons de valence de l'atome isolé) - (Nombre d'électrons non liants) - (1/2 Nombre d'électrons liants)
L'objectif est de minimiser les charges formelles sur chaque atome. Une structure de Lewis avec des charges formelles les plus proches de zéro est généralement plus stable.
Résonance
Dans certains cas, il est possible de dessiner plusieurs structures de Lewis différentes qui respectent les règles de l'octet (ou les exceptions) mais qui diffèrent par la position des liaisons multiples et des paires non liantes. On parle alors de résonance. Ces structures de Lewis individuelles sont appelées formes de résonance ou structures mésomères. La molécule réelle est une combinaison (un hybride) de toutes les formes de résonance possibles.
Par exemple, l'ozone (O3) peut être représenté par deux formes de résonance où la double liaison est alternativement entre l'atome central et l'un des atomes d'oxygène périphériques. La molécule réelle d'ozone est un hybride de ces deux formes, ce qui signifie que les deux liaisons oxygène-oxygène ont une longueur et une force intermédiaires entre une liaison simple et une liaison double.
Applications de la Représentation de Lewis
La représentation de Lewis est utilisée pour :
- Prédire la géométrie moléculaire : En utilisant la théorie VSEPR (Valence Shell Electron Pair Repulsion), on peut déduire la forme tridimensionnelle d'une molécule à partir de sa structure de Lewis.
- Comprendre la polarité des liaisons et des molécules : En identifiant les liaisons polaires et la géométrie de la molécule, on peut déterminer si la molécule est polaire ou non.
- Prédire la réactivité chimique : Les sites riches en électrons (paires non liantes) ou déficients en électrons sont souvent des sites réactifs.
- Concevoir de nouvelles molécules : La représentation de Lewis aide à visualiser comment les atomes peuvent se lier ensemble pour former des molécules stables.
Ce qu'il faut retenir
- La représentation de Lewis est une méthode pour représenter les liaisons chimiques et les paires non liantes dans une molécule.
- Elle se base sur la règle de l'octet (8 électrons autour d'un atome) et la règle du duet (2 électrons pour l'hydrogène).
- Les étapes clés sont : déterminer le nombre d'électrons de valence, identifier l'atome central, dessiner le squelette, distribuer les électrons et vérifier l'octet/duet.
- Il existe des exceptions à la règle de l'octet.
- Les charges formelles aident à déterminer la distribution la plus probable des électrons.
- La résonance se produit quand plusieurs structures de Lewis sont possibles.
- La représentation de Lewis permet de prédire la géométrie, la polarité et la réactivité des molécules.
FAQ
-
Comment déterminer l'atome central dans une molécule ?
L'atome central est généralement l'atome le moins électronégatif (sauf l'hydrogène) et présent en plus petite quantité. Il est souvent l'atome qui peut former le plus de liaisons. -
Que faire si l'atome central n'a pas son octet complet ?
Former des liaisons multiples (doubles ou triples) en déplaçant des paires non liantes des atomes périphériques vers l'atome central. -
Comment gérer les molécules avec un nombre impair d'électrons ?
Il est impossible de satisfaire la règle de l'octet pour tous les atomes. Essayez de minimiser les charges formelles et de placer l'électron non apparié sur l'atome le plus électronégatif si possible.
