Physique-Chimie > Chimie - Cinétique Chimique (Notions) > Vitesse de Réaction > Facteurs influençant la vitesse de réaction (concentration, température, catalyseur)
Facteurs influençant la vitesse de réaction
Découvrez comment la concentration des réactifs, la température du milieu réactionnel et l'utilisation de catalyseurs peuvent modifier la vitesse à laquelle une réaction chimique se déroule. Ce guide détaillé explore les principes fondamentaux de la cinétique chimique et vous offre des exemples concrets pour une meilleure compréhension.
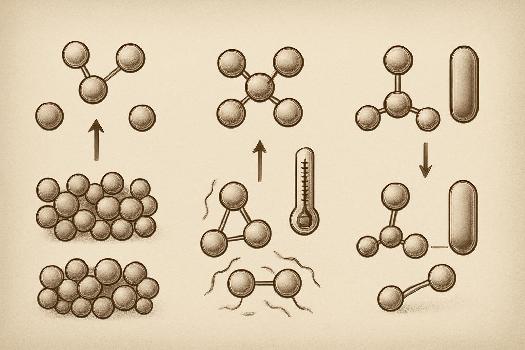
Influence de la concentration des réactifs
La concentration des réactifs est un facteur déterminant de la vitesse de réaction.
- Principe général: Généralement, augmenter la concentration d'un ou plusieurs réactifs accélère la réaction. Pourquoi ? Parce qu'il y a plus de molécules disponibles pour réagir, augmentant ainsi la fréquence des collisions efficaces.
- Loi de vitesse: La relation précise entre la concentration et la vitesse est décrite par la loi de vitesse, qui est déterminée expérimentalement. Cette loi indique comment la vitesse de réaction varie en fonction des concentrations des réactifs. Par exemple, si la loi de vitesse est v = k[A], doubler la concentration de A doublera la vitesse de réaction.
- Ordre de réaction: L'ordre de réaction par rapport à un réactif est l'exposant de sa concentration dans la loi de vitesse. Une réaction d'ordre 1 par rapport à A signifie que la vitesse est directement proportionnelle à [A]. Une réaction d'ordre 2 signifie que la vitesse est proportionnelle à [A]2.
Influence de la température
La température est un autre facteur clé.
- Augmentation de la vitesse: Une augmentation de la température accélère presque toujours une réaction. La raison principale est que l'augmentation de la température fournit plus d'énergie cinétique aux molécules, ce qui augmente la fréquence et l'énergie des collisions.
- Énergie d'activation: Les molécules doivent posséder une énergie minimale, appelée énergie d'activation (Ea), pour que la réaction ait lieu. Augmenter la température permet à davantage de molécules d'atteindre ou de dépasser cette énergie d'activation.
- Équation d'Arrhenius: L'équation d'Arrhenius (k = A * exp(-Ea/RT)) quantifie la relation entre la constante de vitesse (k), la température (T) et l'énergie d'activation (Ea). Elle montre que la constante de vitesse augmente exponentiellement avec la température. R est la constante des gaz parfaits et A est le facteur de fréquence.
Influence des catalyseurs
Un catalyseur est une substance qui accélère une réaction chimique sans être consommé dans le processus.
- Mécanisme d'action: Les catalyseurs abaissent l'énergie d'activation de la réaction en fournissant un chemin réactionnel alternatif. Cela permet à la réaction de se produire plus rapidement, même à des températures plus basses.
- Catalyse homogène et hétérogène: La catalyse homogène se produit lorsque le catalyseur et les réactifs sont dans la même phase (par exemple, tous en solution). La catalyse hétérogène se produit lorsque le catalyseur et les réactifs sont dans des phases différentes (par exemple, un catalyseur solide en présence de réactifs gazeux ou liquides).
- Exemples de catalyseurs: Les enzymes sont des catalyseurs biologiques très efficaces. Dans l'industrie, le platine est souvent utilisé comme catalyseur pour diverses réactions chimiques.
Ce qu'il faut retenir
- Concentration: Augmenter la concentration des réactifs augmente généralement la vitesse de réaction.
- Température: Augmenter la température augmente généralement la vitesse de réaction en fournissant plus d'énergie cinétique aux molécules.
- Catalyseur: Un catalyseur accélère une réaction en abaissant l'énergie d'activation, sans être consommé.
- La loi de vitesse décrit la relation entre la vitesse de réaction et les concentrations des réactifs.
- L'équation d'Arrhenius quantifie la relation entre la constante de vitesse, la température et l'énergie d'activation.
FAQ
-
Pourquoi une augmentation de température accélère-t-elle une réaction ?
L'augmentation de température augmente l'énergie cinétique des molécules, ce qui augmente la fréquence et la force des collisions. Cela permet à davantage de molécules d'atteindre ou de dépasser l'énergie d'activation nécessaire pour que la réaction se produise. -
Quelle est la différence entre un catalyseur homogène et un catalyseur hétérogène ?
Un catalyseur homogène est dans la même phase que les réactifs, tandis qu'un catalyseur hétérogène est dans une phase différente.
