Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Réactions d'Oxydoréduction > Piles électrochimiques (notions)
Introduction aux Piles Électrochimiques
Découvrez le fonctionnement des piles électrochimiques, comment elles convertissent l'énergie chimique en énergie électrique, et les concepts clés à connaître pour le lycée.
Qu'est-ce qu'une pile électrochimique ?
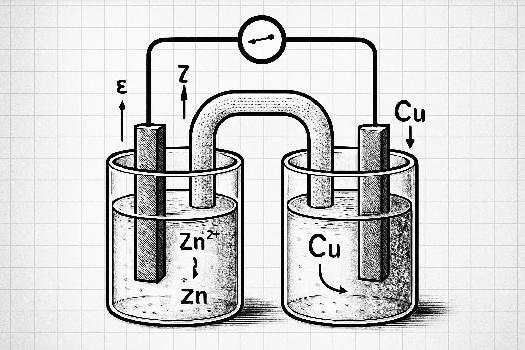
Une pile électrochimique est un dispositif qui convertit l'énergie chimique d'une réaction d'oxydoréduction spontanée en énergie électrique. Elle est constituée de deux demi-piles, chacune contenant une électrode métallique plongée dans une solution électrolytique. Ces demi-piles sont connectées par un pont salin (ou une paroi poreuse) qui permet le passage des ions pour maintenir la neutralité électrique des solutions.
Les composants d'une pile
Une pile est constituée de plusieurs éléments essentiels :
- Les électrodes : Ce sont des conducteurs métalliques où se produisent les réactions d'oxydation (anode) et de réduction (cathode). L'anode est l'électrode où l'oxydation se produit, c'est-à-dire la perte d'électrons. La cathode est l'électrode où la réduction se produit, c'est-à-dire le gain d'électrons.
- Les solutions électrolytiques : Elles contiennent des ions qui permettent la conduction électrique dans chaque demi-pile. Elles sont généralement constituées de sels métalliques dissous dans l'eau.
- Le pont salin : Il relie les deux demi-piles et permet le passage des ions pour maintenir la neutralité électrique des solutions. Il est généralement constitué d'un tube en U rempli d'une solution saline (par exemple, KCl ou NaNO3) maintenue gélifiée. Il empêche également le mélange direct des solutions électrolytiques.
- Circuit extérieur : Un fil conducteur reliant les deux électrodes permet aux électrons de circuler de l'anode vers la cathode, créant ainsi un courant électrique. Un voltmètre peut être inséré dans le circuit pour mesurer la tension (ou potentiel) de la pile.
Le fonctionnement d'une pile : Oxydation et Réduction
Le fonctionnement d'une pile repose sur deux réactions simultanées :
- Oxydation à l'anode : Un métal, par exemple le zinc (Zn), perd des électrons et se transforme en ions Zn2+ qui passent en solution : Zn(s) → Zn2+(aq) + 2e-
- Réduction à la cathode : Des ions métalliques, par exemple les ions cuivre (Cu2+), gagnent des électrons et se déposent sur l'électrode de cuivre (Cu) : Cu2+(aq) + 2e- → Cu(s)
Représentation schématique d'une pile
Une pile peut être représentée schématiquement en utilisant la notation suivante : anode | solution anodique || solution cathodique | cathode. Par exemple, pour la pile Zinc-Cuivre (pile Daniell) : Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s). Les barres verticales simples (|) représentent une interface entre une électrode et sa solution, tandis que les doubles barres verticales (||) représentent le pont salin.
La tension d'une pile
La tension (ou potentiel) d'une pile est la différence de potentiel entre la cathode et l'anode. Elle se mesure en volts (V) et dépend de la nature des métaux utilisés, des concentrations des solutions électrolytiques et de la température. La tension standard d'une pile (E0) est mesurée dans des conditions standard (25°C, concentrations de 1 mol/L). Elle peut être calculée à partir des potentiels standard de réduction des deux demi-réactions : E0pile = E0cathode - E0anode Par exemple, pour la pile Daniell, E0pile = E0Cu2+/Cu - E0Zn2+/Zn = 0.34 V - (-0.76 V) = 1.10 V
Exemple concret : La pile Daniell
La pile Daniell est un exemple classique de pile électrochimique. Elle est constituée d'une électrode de zinc plongée dans une solution de sulfate de zinc (ZnSO4) et d'une électrode de cuivre plongée dans une solution de sulfate de cuivre (CuSO4), reliées par un pont salin. La réaction globale est : Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
Limitations et facteurs influençant la durée de vie d'une pile
Plusieurs facteurs peuvent limiter la durée de vie d'une pile :
- Épuisement des réactifs : Lorsque les réactifs (métaux ou ions) sont consommés, la réaction s'arrête et la pile ne fonctionne plus.
- Polarisation de la pile : L'accumulation de produits de réaction autour des électrodes peut ralentir les réactions et diminuer la tension de la pile.
- Corrosion des électrodes : La corrosion des métaux peut endommager les électrodes et affecter le fonctionnement de la pile.
Ce qu'il faut retenir
- Une pile électrochimique convertit l'énergie chimique en énergie électrique par une réaction d'oxydoréduction spontanée.
- Elle est constituée de deux demi-piles (anode et cathode), d'électrolytes et d'un pont salin.
- L'anode est le siège de l'oxydation (perte d'électrons), et la cathode est le siège de la réduction (gain d'électrons).
- Les électrons circulent de l'anode vers la cathode à travers un circuit extérieur, créant un courant électrique.
- La tension de la pile dépend des potentiels standard de réduction des deux demi-réactions.
- La pile Daniell (Zinc-Cuivre) est un exemple classique de pile électrochimique.
- La durée de vie d'une pile est limitée par l'épuisement des réactifs, la polarisation et la corrosion.
FAQ
-
Quel est le rôle du pont salin dans une pile ?
Le pont salin permet le passage des ions entre les deux demi-piles pour maintenir la neutralité électrique des solutions. Il empêche également le mélange direct des solutions électrolytiques. -
Quelle est la différence entre l'anode et la cathode ?
L'anode est l'électrode où se produit l'oxydation (perte d'électrons), tandis que la cathode est l'électrode où se produit la réduction (gain d'électrons). -
Comment calculer la tension standard d'une pile ?
La tension standard d'une pile (E0pile) est calculée en soustrayant le potentiel standard de réduction de l'anode du potentiel standard de réduction de la cathode : E0pile = E0cathode - E0anode.
