Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Acides et Bases > Définitions (Brønsted-Lowry)
Définition des Acides et Bases selon Brønsted-Lowry
Explorez la théorie de Brønsted-Lowry pour comprendre les acides et les bases. Découvrez comment ils donnent et acceptent des protons (ions H+) dans les réactions chimiques en solution aqueuse.
Introduction à la théorie de Brønsted-Lowry
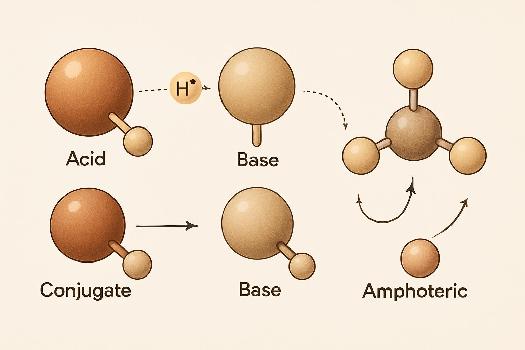
La théorie de Brønsted-Lowry, proposée indépendamment par Johannes Nicolaus Brønsted et Thomas Martin Lowry en 1923, offre une définition plus large des acides et des bases que la théorie d'Arrhenius. Selon Brønsted-Lowry, un acide est une espèce chimique capable de donner un proton (ion H+), tandis qu'une base est une espèce chimique capable d'accepter un proton. Cette définition met l'accent sur le transfert de protons dans les réactions chimiques.
Acide de Brønsted-Lowry : Donneur de protons
Un acide de Brønsted-Lowry est une substance qui cède un proton (H+) à une autre substance. Par exemple, l'acide chlorhydrique (HCl) est un acide de Brønsted-Lowry car il peut donner un proton à l'eau (H2O) lors de sa dissolution dans l'eau :
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Dans cette réaction, HCl donne un proton à H2O, agissant ainsi comme un acide de Brønsted-Lowry. H3O+ est l'ion hydronium.
Base de Brønsted-Lowry : Accepteur de protons
Une base de Brønsted-Lowry est une substance qui accepte un proton (H+) d'une autre substance. L'ammoniac (NH3) est une base de Brønsted-Lowry car il peut accepter un proton de l'eau (H2O) :
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
Ici, NH3 accepte un proton de H2O, agissant comme une base de Brønsted-Lowry. OH- est l'ion hydroxyde.
Paires conjuguées acide-base
Dans une réaction acide-base de Brønsted-Lowry, chaque acide a une base conjuguée, et chaque base a un acide conjugué. La base conjuguée est l'espèce formée lorsque l'acide a perdu un proton, et l'acide conjugué est l'espèce formée lorsque la base a gagné un proton.
Par exemple, dans la réaction de HCl avec H2O, HCl est l'acide et Cl- est sa base conjuguée. H2O est la base et H3O+ est son acide conjugué.
Dans la réaction de NH3 avec H2O, NH3 est la base et NH4+ est son acide conjugué. H2O est l'acide et OH- est sa base conjuguée.
Substances amphotères
Certaines substances, comme l'eau (H2O), peuvent agir à la fois comme un acide et comme une base, selon la réaction. Ces substances sont dites amphotères ou amphiprotiques. Dans la réaction avec HCl, l'eau agit comme une base, tandis que dans la réaction avec NH3, elle agit comme un acide.
Ce qu'il faut retenir
- Acide de Brønsted-Lowry: Donne un proton (H+).
- Base de Brønsted-Lowry: Accepte un proton (H+).
- Paires conjuguées acide-base: Un acide et sa base conjuguée diffèrent par un proton (H+).
- Substances amphotères: Peuvent agir à la fois comme un acide et comme une base (exemple : H2O).
FAQ
-
Quelle est la différence entre la théorie d'Arrhenius et la théorie de Brønsted-Lowry ?
La théorie d'Arrhenius est plus restrictive et ne s'applique qu'aux solutions aqueuses, définissant les acides comme des substances qui produisent des ions H+ et les bases comme des substances qui produisent des ions OH-. La théorie de Brønsted-Lowry est plus générale et définit les acides et les bases en termes de transfert de protons, ce qui permet d'inclure des réactions dans des solvants non aqueux. -
Comment identifier une paire conjuguée acide-base dans une réaction ?
Recherchez les espèces chimiques qui diffèrent par un proton (H+). L'espèce qui a le proton supplémentaire est l'acide, et celle qui a perdu le proton est la base conjuguée. Par exemple, dans la paire HCl / Cl-, HCl est l'acide et Cl- est sa base conjuguée.
