Physique-Chimie > Chimie - Thermochimie (Notions) > Énergie et Réactions Chimiques > Réactions exothermiques et endothermiques
Applications Pratiques des Réactions Exothermiques et Endothermiques
Explorez des exemples concrets de l'utilisation des réactions exothermiques et endothermiques dans la vie quotidienne et dans diverses industries.
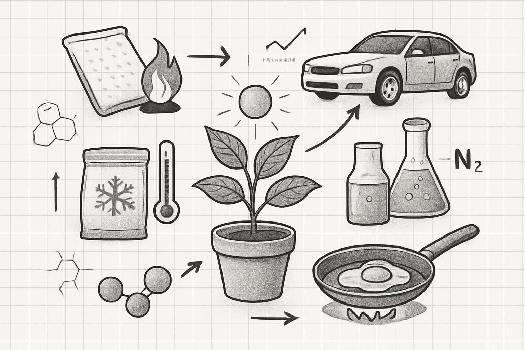
Chaufferettes Chimiques (Réactions Exothermiques)
Les chaufferettes chimiques sont un exemple courant d'application pratique des réactions exothermiques. Elles contiennent généralement un mélange de fer en poudre, de sel (NaCl), d'eau et d'autres composants. Lorsqu'elles sont activées (par exemple, en ouvrant l'emballage et en exposant le mélange à l'air), le fer réagit avec l'oxygène de l'air dans une réaction d'oxydation exothermique, libérant de la chaleur.
Réaction simplifiée :
4Fe(s) + 3O2(g) + 6H2O(l) → 4Fe(OH)3(s) + Énergie
Cette chaleur est utilisée pour réchauffer les mains ou d'autres parties du corps par temps froid. Le sel agit comme catalyseur pour accélérer la réaction.
Sacs de Froid Instantanés (Réactions Endothermiques)
Les sacs de froid instantanés utilisent des réactions endothermiques pour abaisser rapidement la température. Ils contiennent généralement deux compartiments séparés : l'un contenant de l'eau et l'autre contenant un sel, comme le nitrate d'ammonium (NH4NO3). Lorsqu'on brise la séparation, le sel se dissout dans l'eau, absorbant de la chaleur du milieu environnant.
Réaction de dissolution :
NH4NO3(s) + H2O(l) + Énergie → NH4+(aq) + NO3-(aq)
Cette absorption de chaleur refroidit le sac, ce qui permet de l'utiliser pour soulager les douleurs et les inflammations.
Combustion des Carburants (Réactions Exothermiques)
La combustion des carburants, tels que le méthane, le propane et l'essence, est une réaction exothermique largement utilisée pour produire de l'énergie. Ces carburants réagissent avec l'oxygène de l'air, libérant de la chaleur et des gaz (principalement du dioxyde de carbone et de l'eau).
Exemple : Combustion du propane (C3H8) :
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g) + Énergie
Cette énergie est utilisée pour alimenter les moteurs à combustion interne, les centrales électriques et les systèmes de chauffage.
Photosynthèse (Réaction Endothermique)
La photosynthèse est un processus vital pour les plantes et certaines bactéries. C'est une réaction endothermique où le dioxyde de carbone et l'eau sont convertis en glucose (un sucre) et en oxygène, en utilisant l'énergie lumineuse du soleil.
Réaction globale :
6CO2(g) + 6H2O(l) + Énergie lumineuse → C6H12O6(s) + 6O2(g)
L'énergie lumineuse est absorbée par la chlorophylle, un pigment présent dans les chloroplastes des cellules végétales. Le glucose produit est utilisé par la plante comme source d'énergie, et l'oxygène est libéré dans l'atmosphère.
Production d'Ammoniac (Procédé Haber-Bosch) (Réaction Exothermique)
Le procédé Haber-Bosch est une méthode industrielle pour la synthèse de l'ammoniac (NH3) à partir d'azote et d'hydrogène. La réaction est exothermique et réversible.
Réaction :
N2(g) + 3H2(g) ⇌ 2NH3(g) + Énergie
Bien que la réaction soit exothermique, elle nécessite des conditions de haute pression et une température modérée pour être efficace. Un catalyseur à base de fer est également utilisé pour accélérer la réaction. L'ammoniac produit est utilisé comme engrais et dans la fabrication de nombreux produits chimiques.
Cuisine (Réactions Exothermiques et Endothermiques)
La cuisine est remplie de réactions exothermiques et endothermiques. La cuisson d'un gâteau est une combinaison complexe des deux. La cuisson des aliments, comme la friture ou le grillage, implique souvent des réactions de Maillard, qui sont exothermiques et contribuent à la formation de saveurs et d'arômes. La fonte du sucre est endothermique, car elle nécessite de la chaleur pour briser les liaisons intermoléculaires.
L'évaporation de l'eau (pour faire bouillir) est également endothermique.
Ce qu'il faut retenir
- Les réactions exothermiques sont utilisées dans les chaufferettes chimiques et la combustion des carburants pour produire de la chaleur et de l'énergie.
- Les réactions endothermiques sont utilisées dans les sacs de froid instantanés pour abaisser la température et soulager les douleurs.
- La photosynthèse est une réaction endothermique vitale pour la production de glucose et d'oxygène.
- Le procédé Haber-Bosch utilise une réaction exothermique pour la synthèse de l'ammoniac, un engrais essentiel.
- La cuisine implique un mélange complexe de réactions exothermiques et endothermiques, contribuant à la transformation des aliments.
FAQ
-
Pourquoi les centrales électriques utilisent-elles des réactions exothermiques?
Les centrales électriques utilisent des réactions exothermiques, comme la combustion du charbon ou du gaz naturel, pour produire de la chaleur. Cette chaleur est ensuite utilisée pour vaporiser de l'eau, et la vapeur sous pression fait tourner des turbines connectées à des générateurs électriques, produisant ainsi de l'électricité. -
Comment la connaissance des réactions exothermiques et endothermiques est-elle utilisée dans la recherche en chimie?
La connaissance des réactions exothermiques et endothermiques est essentielle pour concevoir et optimiser les réactions chimiques. Les chimistes utilisent ces informations pour déterminer les conditions de réaction optimales (température, pression, catalyseurs) afin de maximiser le rendement des produits souhaités et de minimiser les sous-produits indésirables. Cela est particulièrement important dans l'industrie pharmaceutique et chimique. -
Les réactions nucléaires sont-elles exothermiques ou endothermiques?
Les réactions nucléaires peuvent être soit exothermiques, soit endothermiques, selon les noyaux impliqués. La fission nucléaire (comme celle de l'uranium) est une réaction exothermique qui libère une énorme quantité d'énergie. La fusion nucléaire (comme celle qui se produit dans le soleil) est également exothermique et libère encore plus d'énergie par unité de masse. Cependant, certaines réactions nucléaires peuvent nécessiter une entrée d'énergie pour se produire, ce qui les rend endothermiques.
