Physique-Chimie > Chimie et Développement Durable > Énergie et Chimie > Stockage de l'énergie (batteries, piles à combustible - principes chimiques)
Le Stockage de l'Énergie : Batteries et Piles à Combustible
Découvrez les principes chimiques fondamentaux des batteries et des piles à combustible, deux technologies clés pour le stockage de l'énergie et le développement durable. Comprenez leur fonctionnement, leurs avantages et leurs inconvénients, ainsi que leur rôle dans la transition énergétique.
Introduction au Stockage de l'Énergie Chimique
Le stockage de l'énergie est un défi majeur du 21ème siècle. La demande croissante en énergie, combinée à la nécessité de réduire les émissions de gaz à effet de serre, rend indispensable le développement de solutions de stockage efficaces et durables. Les batteries et les piles à combustible représentent deux approches prometteuses pour relever ce défi. Elles convertissent l'énergie chimique en énergie électrique, et inversement pour certaines batteries rechargeables. Contrairement aux combustibles fossiles, elles peuvent être alimentées par des sources d'énergie renouvelables, contribuant ainsi à une économie plus propre et plus durable.
Les Batteries : Accumulateurs d'Énergie
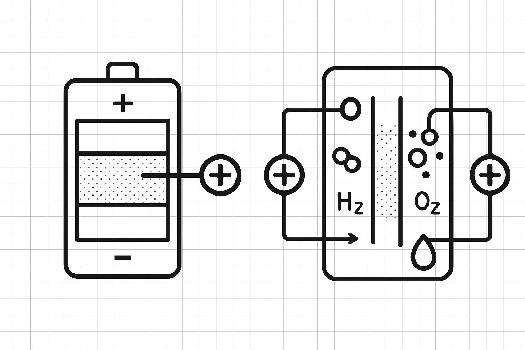
Une batterie est un dispositif électrochimique qui convertit l'énergie chimique en énergie électrique par le biais de réactions d'oxydoréduction. Elle est constituée de plusieurs éléments : deux électrodes (une anode et une cathode) immergées dans un électrolyte.
- Anode: L'électrode négative où a lieu l'oxydation (perte d'électrons).
- Cathode: L'électrode positive où a lieu la réduction (gain d'électrons).
- Électrolyte: Un milieu conducteur ionique qui permet le mouvement des ions entre les électrodes, assurant ainsi la fermeture du circuit électrique.
Fonctionnement d'une Batterie Lithium-ion
Les batteries Lithium-ion sont devenues omniprésentes en raison de leur excellente densité énergétique. Voici comment elles fonctionnent :
- Décharge : Lors de la décharge, les ions lithium (Li+) se déplacent de l'anode (généralement en graphite) à la cathode (généralement un oxyde métallique, comme le LiCoO2) à travers l'électrolyte. Les électrons libérés par l'anode circulent dans le circuit externe, alimentant l'appareil.
- Charge : Lors de la charge, le processus est inversé. Les ions lithium retournent de la cathode à l'anode, et les électrons sont forcés de revenir à l'anode grâce à une source d'énergie externe.
- Haute densité énergétique
- Faible taux d'autodécharge
- Pas d'effet mémoire (contrairement aux batteries Ni-Cd)
- Coût plus élevé
- Sensibilité à la température
- Risque d'emballement thermique (dans de rares cas)
Les Piles à Combustible : Une Énergie Propre et Continue
Une pile à combustible est un dispositif électrochimique qui convertit directement l'énergie chimique d'un combustible (généralement l'hydrogène) et d'un oxydant (généralement l'oxygène) en énergie électrique, avec de la chaleur et de l'eau comme seuls sous-produits. Contrairement aux batteries, les piles à combustible ne se déchargent pas; elles continuent à produire de l'électricité tant qu'elles sont alimentées en combustible et en oxydant. Une pile à combustible est constituée de trois composants principaux :
- Anode: L'électrode où le combustible (hydrogène) est oxydé.
- Cathode: L'électrode où l'oxydant (oxygène) est réduit.
- Électrolyte: Un milieu conducteur ionique qui permet le mouvement des ions entre les électrodes.
Fonctionnement d'une Pile à Combustible à Membrane Échangeuse de Protons (PEMFC)
Les piles à combustible PEMFC (Proton Exchange Membrane Fuel Cell) sont l'un des types de piles à combustible les plus prometteurs pour les applications mobiles et stationnaires. Voici comment elles fonctionnent :
- À l'anode : L'hydrogène gazeux (H2) est introduit et catalysé pour former des ions hydrogène (protons, H+) et des électrons (e-) : H2 -> 2H+ + 2e-
- À travers la membrane : La membrane polymère (électrolyte) permet uniquement le passage des protons (H+) vers la cathode.
- À la cathode : L'oxygène gazeux (O2) est introduit et réagit avec les protons (H+) et les électrons (e-) pour former de l'eau (H2O) : O2 + 4H+ + 4e- -> 2H2O
- Haute efficacité
- Faibles émissions (seulement de l'eau)
- Fonctionnement silencieux
- Coût élevé (lié à l'utilisation de catalyseurs à base de platine)
- Sensibilité à la pureté de l'hydrogène
- Durée de vie limitée
Comparaison Batteries et Piles à Combustible
Bien que les batteries et les piles à combustible soient toutes deux des dispositifs de stockage de l'énergie, elles présentent des différences fondamentales :
| Caractéristique | Batteries | Piles à Combustible |
|---|---|---|
| Stockage de l'énergie | Intégré (énergie stockée à l'intérieur) | Externe (nécessite un approvisionnement continu en combustible) |
| Décharge | Limitée par la capacité de la batterie | Continue tant qu'il y a du combustible |
| Recharge | Possible (pour les batteries rechargeables) | Non applicable (nécessite un réapprovisionnement en combustible) |
| Applications | Appareils électroniques portables, véhicules électriques, stockage stationnaire | Véhicules électriques, production d'électricité stationnaire, alimentation de secours |
Impact Environnemental et Développement Durable
Les batteries et les piles à combustible jouent un rôle crucial dans la transition vers une économie plus durable. Elles permettent de réduire la dépendance aux combustibles fossiles en facilitant l'intégration des énergies renouvelables dans le réseau électrique et en alimentant les véhicules électriques. Cependant, il est important de prendre en compte leur impact environnemental tout au long de leur cycle de vie. L'extraction des matériaux utilisés dans les batteries (lithium, cobalt, etc.) peut avoir des conséquences environnementales et sociales importantes. De même, la production d'hydrogène pour les piles à combustible peut générer des émissions de gaz à effet de serre si elle est réalisée à partir de combustibles fossiles. Il est donc essentiel de développer des procédés de fabrication plus durables et de promouvoir le recyclage des batteries et des piles à combustible.
Ce qu'il faut retenir
- Batteries: Dispositifs électrochimiques stockant l'énergie via des réactions d'oxydoréduction, comprenant une anode, une cathode et un électrolyte. Les batteries Lithium-ion sont courantes pour leur haute densité énergétique.
- Piles à combustible: Convertissent l'énergie chimique en énergie électrique à partir d'un combustible (souvent l'hydrogène) et d'un oxydant (souvent l'oxygène), produisant de l'eau et de la chaleur.
- PEMFC: Un type de pile à combustible utilisant une membrane échangeuse de protons, offrant une haute efficacité et de faibles émissions.
- Avantages des Batteries: Portabilité, rechargeabilité (pour certains types).
- Inconvénients des Batteries: Capacité limitée, impact environnemental lié à l'extraction des matériaux.
- Avantages des Piles à Combustible: Énergie continue tant qu'il y a du combustible, faibles émissions (eau).
- Inconvénients des Piles à Combustible: Coût élevé, nécessité d'hydrogène pur, durée de vie limitée.
- Applications: Les batteries sont utilisées dans les appareils électroniques et les véhicules électriques; les piles à combustible dans les véhicules, la production d'électricité et l'alimentation de secours.
- Développement Durable: Les batteries et les piles à combustible sont cruciales pour la transition énergétique, mais il faut considérer leur impact environnemental et promouvoir des pratiques durables.
FAQ
-
Quelle est la différence principale entre une batterie et une pile à combustible ?
Une batterie stocke l'énergie chimiquement et la libère jusqu'à épuisement, tandis qu'une pile à combustible convertit continuellement l'énergie chimique d'un combustible en électricité tant qu'elle est alimentée. -
Quels sont les avantages et les inconvénients des batteries lithium-ion ?
Avantages: Haute densité énergétique, faible taux d'autodécharge, pas d'effet mémoire. Inconvénients: Coût plus élevé, sensibilité à la température, risque (rare) d'emballement thermique. -
Qu'est-ce qu'une pile à combustible PEMFC et quels sont ses avantages ?
Une pile à combustible PEMFC (Proton Exchange Membrane Fuel Cell) utilise une membrane échangeuse de protons pour convertir l'hydrogène et l'oxygène en électricité, avec de l'eau comme seul sous-produit. Ses avantages incluent une haute efficacité et de faibles émissions. -
Quel est l'impact environnemental des batteries et des piles à combustible ?
L'extraction des matériaux pour les batteries et la production d'hydrogène peuvent avoir un impact environnemental. Il est crucial de développer des procédés de fabrication durables et de promouvoir le recyclage.
