Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Acides et Bases > Définitions (Brønsted-Lowry)
Exemples d'Acides et de Bases de Brønsted-Lowry
Découvrez des exemples concrets d'acides et de bases de Brønsted-Lowry, et comprenez comment identifier les paires conjuguées dans différentes réactions chimiques.
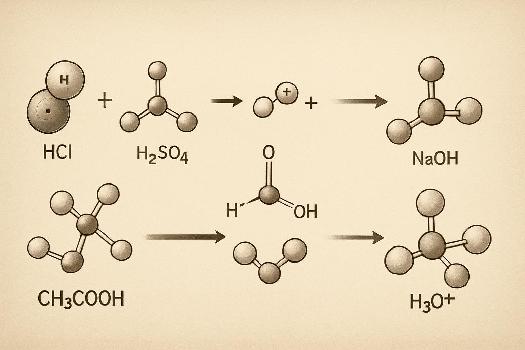
Acides courants de Brønsted-Lowry
Voici quelques exemples d'acides courants de Brønsted-Lowry et leur comportement en solution aqueuse:
- Acide chlorhydrique (HCl): Un acide fort qui se dissocie complètement dans l'eau : HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
- Acide sulfurique (H2SO4): Un acide diprotique, c'est-à-dire qu'il peut donner deux protons. La première dissociation est forte : H2SO4(aq) + H2O(l) → H3O+(aq) + HSO4-(aq)
- Acide acétique (CH3COOH): Un acide faible qui ne se dissocie que partiellement dans l'eau : CH3COOH(aq) + H2O(l) ⇌ H3O+(aq) + CH3COO-(aq)
Bases courantes de Brønsted-Lowry
Voici quelques exemples de bases courantes de Brønsted-Lowry et leur comportement en solution aqueuse:
- Hydroxyde de sodium (NaOH): Une base forte qui se dissocie complètement dans l'eau : NaOH(s) → Na+(aq) + OH-(aq)
- Ammoniac (NH3): Une base faible qui accepte un proton de l'eau : NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
- Ion carbonate (CO32-): Une base qui accepte des protons de l'eau : CO32-(aq) + H2O(l) ⇌ HCO3-(aq) + OH-(aq)
Identification des paires conjuguées
Pour identifier les paires conjuguées dans une réaction acide-base, suivez ces étapes:
- Identifiez les espèces qui donnent ou acceptent un proton.
- L'espèce qui donne un proton est l'acide, et ce qui reste après la perte du proton est sa base conjuguée.
- L'espèce qui accepte un proton est la base, et ce qui est formé après l'acceptation du proton est son acide conjugué.
Importance du solvant
Le solvant joue un rôle crucial dans les réactions acide-base de Brønsted-Lowry. L'eau est un solvant courant car elle peut agir à la fois comme un acide et comme une base. Le solvant peut influencer la force des acides et des bases, ainsi que l'équilibre de la réaction. Il est également important de noter que la force d'un acide ou d'une base dépend du solvant utilisé. Un acide peut être fort dans un solvant et faible dans un autre.
Ce qu'il faut retenir
- Acides courants: HCl, H2SO4, CH3COOH (acide acétique).
- Bases courantes: NaOH, NH3, CO32- (ion carbonate).
- Identifier les paires conjuguées: Chercher les espèces qui diffèrent par un proton (H+).
- Le solvant: Influence la force des acides et des bases. L'eau est un solvant amphotère courant.
FAQ
-
Un acide faible peut-il réagir avec une base forte ?
Oui, un acide faible peut réagir avec une base forte. La réaction se produira, mais l'équilibre peut être déplacé vers les réactifs plutôt que vers les produits, en fonction des forces relatives de l'acide et de la base. -
Pourquoi l'eau est-elle considérée comme un solvant amphotère ?
L'eau est considérée comme un solvant amphotère car elle peut agir à la fois comme un acide et comme une base. Elle peut donner un proton (H+) à une base, ou accepter un proton d'un acide, selon la réaction.
