Physique-Chimie > Chimie - Chimie des Solutions Aqueuses > Acides et Bases > pH
Titrage Acide-Base : Guide Pratique
Apprenez les principes fondamentaux du titrage acide-base, une technique de laboratoire essentielle pour déterminer la concentration d'un acide ou d'une base inconnue. Ce guide pas à pas est spécialement conçu pour les élèves de lycée et comprend des exemples concrets et des conseils pratiques.
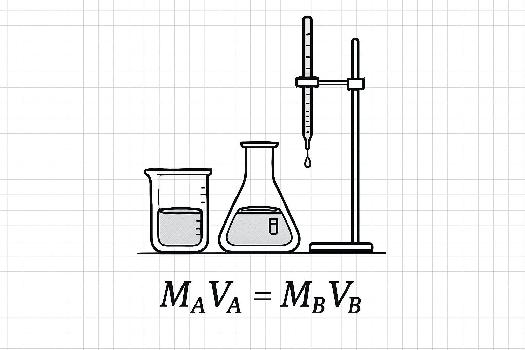
Principe du Titrage Acide-Base
Le titrage acide-base, aussi appelé neutralisation, est une technique de laboratoire qui permet de déterminer la concentration d'un acide ou d'une base en la faisant réagir avec une base ou un acide de concentration connue. La réaction est suivie jusqu'à ce que la quantité d'acide et de base soient stœchiométriquement équivalentes, c'est-à-dire qu'elles se neutralisent complètement. Ce point est appelé point d'équivalence.
Pour déterminer le point d'équivalence, on utilise généralement un indicateur de pH, qui change de couleur dans une plage de pH proche du point d'équivalence. On peut aussi utiliser un pH-mètre pour suivre la variation du pH au cours du titrage et identifier le point où la variation du pH est la plus rapide. Ce point est appelé point de virage de l'indicateur.
Le titrage est une méthode quantitative, ce qui signifie qu'elle permet de déterminer la quantité exacte d'une substance. Il est essentiel en chimie analytique pour contrôler la qualité des produits, déterminer la concentration des solutions, et étudier les réactions chimiques.
Matériel Nécessaire
Pour réaliser un titrage acide-base, vous aurez besoin du matériel suivant :
- Burette : Un tube gradué avec un robinet, utilisé pour ajouter la solution titrante (la solution de concentration connue) avec précision.
- Erlenmeyer : Un récipient conique pour contenir la solution à titrer (la solution de concentration inconnue).
- Pipette : Utilisée pour prélever un volume précis de la solution à titrer et le transférer dans l'erlenmeyer.
- Agitateur magnétique et barreau aimanté (facultatif) : Pour assurer un mélange homogène de la solution pendant le titrage.
- Indicateur de pH : Une substance qui change de couleur en fonction du pH de la solution. Le choix de l'indicateur dépend du point d'équivalence de la réaction.
- Solution titrante : La solution d'acide ou de base de concentration connue, utilisée pour titrer la solution de concentration inconnue.
- Solution à titrer : La solution d'acide ou de base de concentration inconnue, dont on souhaite déterminer la concentration.
Procédure de Titrage
Voici les étapes à suivre pour réaliser un titrage acide-base :
- Préparation :
- Rincer soigneusement la burette avec de l'eau distillée, puis avec la solution titrante.
- Remplir la burette avec la solution titrante et ajuster le niveau à zéro.
- Pipetter un volume précis de la solution à titrer dans l'erlenmeyer.
- Ajouter quelques gouttes de l'indicateur de pH approprié dans l'erlenmeyer.
- Titrage :
- Placer l'erlenmeyer sous la burette et commencer à ajouter la solution titrante goutte à goutte, en agitant constamment l'erlenmeyer (ou en utilisant l'agitateur magnétique).
- Observer attentivement la couleur de la solution dans l'erlenmeyer. Au fur et à mesure que la solution titrante est ajoutée, la couleur changera progressivement.
- Ralentir l'ajout de la solution titrante lorsque la couleur de la solution approche du point de virage de l'indicateur.
- Ajouter la solution titrante goutte à goutte jusqu'à ce que la couleur de la solution change de manière permanente, indiquant que le point d'équivalence est atteint.
- Mesure et Calcul :
- Noter le volume de solution titrante utilisé pour atteindre le point d'équivalence.
- Utiliser la stœchiométrie de la réaction et le volume de solution titrante utilisé pour calculer la concentration de la solution à titrer.
Calcul de la Concentration
Pour calculer la concentration de la solution à titrer, utilisez la stœchiométrie de la réaction de neutralisation et la formule suivante :
MAVA = MBVB
Où :
- MA est la molarité (concentration molaire) de l'acide.
- VA est le volume de l'acide utilisé pour atteindre le point d'équivalence.
- MB est la molarité (concentration molaire) de la base.
- VB est le volume de la base utilisé pour atteindre le point d'équivalence.
Il est important de tenir compte du coefficient stœchiométrique si la réaction n'est pas une réaction 1:1 (par exemple, si un acide diprotique réagit avec une base monovalent). Dans ce cas, la formule doit être ajustée en conséquence.
Précautions et Erreurs
Pour obtenir des résultats précis, il est important de prendre certaines précautions :
- Rinçage du matériel : Assurez-vous que tout le matériel est propre et rincé correctement pour éviter toute contamination.
- Lecture précise des volumes : Lisez attentivement les volumes sur la burette et la pipette, en tenant compte du ménisque.
- Agitation constante : Assurez-vous que la solution est constamment agitée pendant le titrage pour assurer un mélange homogène.
- Choix de l'indicateur : Choisissez un indicateur dont la zone de virage de pH se situe le plus près possible du point d'équivalence de la réaction.
- Eviter les erreurs de parallaxe : Positionnez-vous correctement lors de la lecture des volumes pour éviter les erreurs de parallaxe.
Les erreurs courantes dans un titrage incluent une mauvaise préparation des solutions, une lecture incorrecte des volumes, et un choix inapproprié de l'indicateur.
Ce qu'il faut retenir
- Le titrage acide-base permet de déterminer la concentration d'un acide ou d'une base inconnue en utilisant une solution de concentration connue.
- Le point d'équivalence est atteint lorsque la quantité d'acide et de base sont stœchiométriquement équivalentes.
- Un indicateur de pH est utilisé pour visualiser le point d'équivalence.
- La concentration de la solution inconnue peut être calculée en utilisant la formule MAVA = MBVB (en tenant compte des coefficients stœchiométriques si nécessaire).
- Une préparation rigoureuse, une lecture précise des volumes et un choix approprié de l'indicateur sont essentiels pour un titrage réussi.
FAQ
-
Pourquoi est-il important d'agiter la solution pendant le titrage ?
L'agitation constante assure que la solution titrante est uniformément dispersée dans la solution à titrer. Cela permet d'éviter les concentrations locales élevées de titrant, qui pourraient entraîner une surestimation du point d'équivalence. -
Comment choisir le bon indicateur de pH pour un titrage ?
Le choix de l'indicateur dépend du pH au point d'équivalence. Idéalement, la zone de virage de l'indicateur doit se situer le plus près possible du point d'équivalence. Si vous titrez un acide fort avec une base forte, le pH au point d'équivalence sera de 7, donc un indicateur comme le bleu de bromothymol (zone de virage entre pH 6.0 et 7.6) serait approprié.
