Physique-Chimie > Chimie - La Matière et ses Transformations > Transformations Physiques > Diagrammes de phases (notions)
Introduction aux Diagrammes de Phases
Explorez les diagrammes de phases pour comprendre les états de la matière (solide, liquide, gazeux) et les conditions de température et de pression qui les régissent. Découvrez comment ces diagrammes permettent de prédire les transitions de phase et les propriétés des substances.
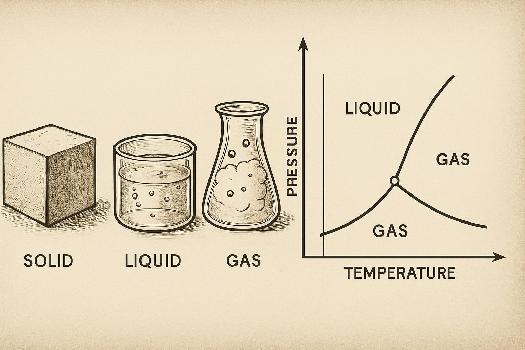
Qu'est-ce qu'un diagramme de phases ?
Un diagramme de phases est une représentation graphique qui montre les phases (solide, liquide, gaz) d'une substance en fonction de la température et de la pression. Il indique les conditions dans lesquelles une substance est stable dans chaque phase et les conditions où les phases coexistent en équilibre.
L'axe horizontal représente généralement la température (en degrés Celsius ou Kelvin), tandis que l'axe vertical représente la pression (en Pascal, Bar ou atmosphères). Le diagramme est divisé en régions, chaque région représentant une phase stable. Les lignes qui séparent ces régions indiquent les conditions de température et de pression où deux phases coexistent en équilibre (par exemple, la fusion solide-liquide ou l'ébullition liquide-gaz).
Points et Courbes Caractéristiques
Les diagrammes de phases comportent des points et des courbes spécifiques :
- Courbe de fusion: Sépare la phase solide de la phase liquide. Elle indique la température de fusion à différentes pressions.
- Courbe de vaporisation: Sépare la phase liquide de la phase gazeuse. Elle indique la température d'ébullition à différentes pressions.
- Courbe de sublimation: Sépare la phase solide de la phase gazeuse. Elle indique la température de sublimation à différentes pressions.
- Point triple: Le point où les trois courbes se rencontrent. À ce point précis de température et de pression, les trois phases (solide, liquide et gazeux) coexistent en équilibre.
- Point critique: Le point final de la courbe de vaporisation. Au-delà de ce point, il n'y a plus de distinction claire entre les phases liquide et gazeuse ; on parle de fluide supercritique.
Interprétation d'un Diagramme de Phases
Pour interpréter un diagramme de phases, suivez ces étapes:
- Identifiez les axes: Déterminez quelles sont les variables représentées (généralement température et pression).
- Localisez les régions: Identifiez les régions correspondant aux phases solide, liquide et gazeuse.
- Analysez les courbes: Les courbes indiquent les conditions où les transitions de phase se produisent. Par exemple, si vous traversez la courbe de fusion en augmentant la température, la substance passe de l'état solide à l'état liquide.
- Considérez les points spéciaux: Le point triple et le point critique offrent des informations importantes sur le comportement de la substance.
Exemple : Si on prend de l'eau à une pression de 1 atm (pression atmosphérique standard) et qu'on augmente sa température, on observe d'abord une phase solide (glace) jusqu'à 0°C (point de fusion). À 0°C, la glace fond et se transforme en eau liquide. Si on continue à chauffer l'eau, elle reste liquide jusqu'à 100°C (point d'ébullition). À 100°C, l'eau bout et se transforme en vapeur.
Applications des Diagrammes de Phases
Les diagrammes de phases ont de nombreuses applications :
- Science des matériaux: Ils aident à comprendre les propriétés des matériaux et à concevoir des alliages avec des propriétés spécifiques.
- Chimie: Ils permettent de prédire le comportement des substances dans différentes conditions et d'optimiser les processus chimiques.
- Géologie: Ils aident à comprendre la formation des roches et des minéraux en fonction de la température et de la pression dans le sous-sol terrestre.
- Ingénierie: Ils sont utilisés pour concevoir des systèmes de refroidissement, de chauffage et de séparation.
Exemple concret : Le diagramme de phase de l'eau
Le diagramme de phase de l'eau est un excellent exemple pour comprendre ces concepts.
Courbe de fusion (glace-eau liquide) : La pente de cette courbe est négative. Cela signifie que, contrairement à la plupart des substances, augmenter la pression sur de la glace diminue son point de fusion. C'est pourquoi la glace patine sous la pression des lames de patin à glace.
Courbe de vaporisation (eau liquide-vapeur) : Cette courbe montre comment la température d'ébullition de l'eau augmente avec la pression. Par exemple, en haute altitude, où la pression atmosphérique est plus faible, l'eau bout à une température inférieure à 100°C.
Point triple : Pour l'eau, le point triple se situe à environ 0,01°C et 611,66 Pa. À cette température et pression exactes, la glace, l'eau liquide et la vapeur d'eau coexistent en équilibre.
Ce qu'il faut retenir
- Un diagramme de phases est une représentation graphique des phases d'une substance en fonction de la température et de la pression.
- Il comporte des courbes de fusion, de vaporisation et de sublimation, ainsi qu'un point triple et un point critique.
- Il permet de prédire les transitions de phase et d'optimiser les processus dans divers domaines scientifiques et industriels.
- Le diagramme de phase de l'eau est un exemple concret illustrant ces concepts, avec une pente négative pour la courbe de fusion et un point triple spécifique.
FAQ
-
Pourquoi la courbe de fusion de l'eau a-t-elle une pente négative ?
La courbe de fusion de l'eau a une pente négative car la glace est moins dense que l'eau liquide. Augmenter la pression favorise la phase la plus dense, donc la phase liquide, ce qui diminue le point de fusion. -
Qu'est-ce qu'un fluide supercritique ?
Un fluide supercritique est une substance qui se trouve à une température et une pression supérieures à son point critique. Dans cet état, il n'y a plus de distinction claire entre les phases liquide et gazeuse. Il possède des propriétés intermédiaires entre un liquide et un gaz, ce qui le rend utile dans de nombreuses applications industrielles, comme l'extraction de caféine du café.
